
Actas del Congreso Nacional de
Tecnología Aplicada a Ciencias
de la Salud



Actas del Congreso Nacional de Tecnología Aplicada a Ciencias de la Salud Vol. 1, 2018
La glicinamida administrada por vía intraperitoneal o ingerida por ratas privadas de agua durante 24 horas aumenta el umbral del dolor, lo que sugiere que este fármaco induce la antinocicepción. Pero no sabemos si su ingestión crónica es antinociceptiva. Las ratas ovariectomizadas ingirieron una solución de azúcar al 10% con glicinamida (0, 50, 100 y 200 mg / 5 ml) durante siete días y evaluaron el umbral de vocalización a descarga eléctrica (VTTS) a la cola de la rata en libre movimiento, en días 1, 2, 4, 7, 8 y 10 días. La glicinamida aumentó significativamente (p <0.05) VTTS a un máximo de 30% el día siete en comparación con VTTS de ratas que solo ingirieron la solución de azúcar. Desde el día 8, el VTTS es menor hasta el día 10. Los datos muestran que la glicinamida se puede ingerir de forma crónica para reducir el proceso de dolor.
Palabras claves: dolor crónico, glicinamida, glicina
Glycinamide administered intraperitoneally or ingested by water-deprived rats for 24 hours raises the pain threshold, suggesting that this drug induces antinociception. But we do not know if its chronic ingestion is antinociceptive. The ovariectomized rats ingested a 10% sugar solution with glycinamide (0, 50, 100 and 200 mg / 5 ml) for seven days and evaluated the threshold of vocalization to electric shock (VTTS) to the tail of the rat in free movement , on days 1, 2, 4, 7, 8 and 10 days. Glycinamide increased significantly (p <0.05) VTTS to a maximum of 30% on day seven compared to VTTS of rats that only ingested the sugar solution. From day 8, the VTTS is lower until day 10. The data show that glycinamide can be ingested chronically to reduce the pain process.
Key words: chronic pain, glycinamide, glicine
La búsqueda de analgésicos que calmen el dolor sin efectos colaterales siempre ha sido un problema, ya que no hay un analgésico el cual solo alivie el dolor sin causar otros problemas de salud. Sin embargo, el organismo tiene sus propios analgésicos como la glicina. Un amino acido que tiene propiedades antinociceptivas. Beyer y col., (1985) reportaron que al bloquear los receptores de glicina por la administración de estricnina, un antagonista de glicina, resulto que las ratas respondieron con una alta sensibilidad a los estímulos dolorosos y no dolorosos. Lim y Lee (2010) confirmaron estos datos en el ratón. Esta alta sensibilidad dolorosa observada en las ratas fue reducida en otro experimento en el que se administró glicina y otros aminoácidos de estructura química similar, que se unen al receptor de glicina (Beyer y col., 1988). Estos datos mostraron que glicina podría ser utilizado como un analgésico (Lynch y Callister, 2006). Pero, glicina penetra al cerebro pobremente y se requiere de administrar dosis elevadas (Laftha y Toth, 1961). Una alternativa es utilizar compuestos que al ser administrados puedan elevar los niveles endógenos de glicina al administrar precursores de glicina como la glicinamida que entra rápidamente al cerebro y se convierte en glicina (Jansen y col., 1988; Semba y Pastalos, 1993; Semba y col., 1991). Así, se ha reportado que la administración sistémica de glicinamida aumenta el umbral al dolor en la rata en libre movimiento y en restricción (Beyer y cols., 2013). Lo cual indica que puede ser un analgésico en el tratamiento del dolor. Por lo general, los analgésicos son de uso oral. Así que, los autores decidieron estudiar ¿si la ingestión de glicinamida produce analgesia? Ellos utilizaron el modelo de la rata privada de agua por 24 horas y luego le dieron a tomar la glicinamida disuelta en agua, sus resultados muestran que las ratas tuvieron un alto umbral a los estímulos dolorosos desde los 10 minutos después de la ingestión llegando al máximo de 60 a 90 minutos posteriores a la ingestión, ciento veinte minutos después decae y se mantiene por 4 horas (Beyer y col., 2013). Estos datos indican que la glicinamida tiene un efecto agudo tanto por la administración sistémica como por la ingestión. Ahora suponemos que la ingestión crónica de glicinamida puede tener un efecto antinociceptivo, de manera que pueda ser utilizado en el tratamiento del dolor crónico. Por lo que, en el presente trabajo estudiamos si la ingestión crónica de la glicinamida disuelta en una solución azucarada al 10% produce antinocicepcion en la rata en libre movimiento.
Se utilizaron ratas hembras (200-250 gramos) del bioterio del laboratorio Tlaxcala del CINVESTAV. Todas mantenidas en un ciclo de luz de 14 horas y 10 de oscuridad. La luz se enciende a las ocho de la noche y se apaga a las 10 de mañana. El agua y el alimento están disponibles las 24 horas del día. El bioterio es mantenido con humedad del 60% y temperatura constante 23ºC más 1 y menos 1ºC.
A las ratas hembras se les extirparon los ovarios bajo anestesia con una mezcla de ketamina 50 mg/kg y Xilacina 4 mg/kg, la rata anestesiada se colocó sobre una mesa de cirugía con la región ventral hacia arriba. Entonces se cortó la piel, luego el musculo de la región ventral, se localizó un cuerno uterino para llegar al ovario el cual se ligó y se cortó con unas tijeras. Se repitió el mismo proceso quirúrgico con el otro cuerno uterino. Luego se procedió a suturar tanto el musculo como la piel con catgut. Se desinfecto la herida y se inyecto por vía intramuscular una dosis de antibiótico para evitar una posible infección. Con el propósito de que los datos no sean afectados por los cambios hormonales del ciclo estral de la rata se hizo la ovariotomía.
Una semana después de la cirugía las ratas fueron llevadas al cuarto de experimentación para entrenarlas a tomar una solución de agua con azúcar al 10%. Las ratas fueron colocadas en una jaula individual (32X20X18 cm) de acrílico transparente con tapa de reja y diez minutos después se abrió hacia atrás y se acercó una jeringa de 5 ml (sin la aguja ) con el agua azucarada luego de unos minutos la rata se acercó a explorar la jeringa y detecto el agua azucarada después de unos 30 minutos la rata empezó a lamer la punta de la jeringa, esta conducta la hizo en varias ocasiones hasta que finalmente se terminó el contenido de la jeringa. Este proceso de aprendizaje se repitió por tres o cuatro días (Domínguez-Rodríguez, 2014. Disertación de tesis de licenciatura).
Una semana después del entrenamiento de la ingestión de la solución azucarada al 10%, las ratas fueron llevadas al cuarto de experimentación y se colocaron en una jaula redonda de acrílico transparente de 50 cm de diámetro por 40 cm de alto. Al minuto cinco se les fijo un par de electrodos en la base de la cola. Los electrodos están conectados a un estimulador de corriente de DC. Y se les aplicaron pulsos cuadrados de 60 Hz y 300 milisegundos de duración con intensidad creciente cada 100 µA hasta que la rata emitió una vocalización audible. Luego de bajo la intensidad del choque eléctrico en el mismo orden decreciente hasta que la rata no vocalizó. Este proceso de registro se repitió por tres ocasiones para obtener 3 valores de vocalización de la rata, los cuales se promediaron para obtener el umbral de vocalización (UVCE) basal (5) González-Mariscal y cols., 1992). De inmediato se retiró la rata y se colocó en la jaula individual para que tomara la glicinamida (0, 50, 100 o 200 mg/ 5 ml en la solución azucarada al 10%). Al día siguiente, a las ratas se les registró el UVCE con el mismo proceso y los días 4, 7, 8 y 10 del experimento. La ingestión de glicinamida se les dio diario a las ratas hasta el día 7.
Con la idea de ver si la ingestión crónica dos veces al día aumenta el UVCE en la rata en libre movimiento. Se repitió el mismo experimento que el anterior, pero en este caso las ratas ingirieron la glicinamida dos veces al día (una en la mañana y otra en la tarde).
Los valores del UVCE de los días 2, 4, 7, 8 y 10 se calcularon como porcentaje de cambio en base al UVCE basal (día 1) y fueron analizados con una prueba de análisis de varianza de datos no paramétricos de Kruscal-Wallis, para datos pareados se analizaron con una U de Mann-Whitney, considerando una probabilidad significativa de p<0.05.
La figura 1A muestra el efecto de la ingestión una vez al día de la glicinamida sobre el UVCE. El análisis de varianza de rangos fue hecho con la prueba de Friedman, la cual reveló que la ingestión crónica de la glicinamida tuvo un efecto antinociceptivo (F=28.9, grados de liberta 3, p<0.001). El análisis de varianza de rangos de una vía con la prueba de Kruscal-Wallis, mostro que la ingestión crónica de glicinamida produjo un efecto significativamente (KW=10.7, GL=3, p<0.001) antinociceptivo solo el día 7 del experimento. En comparación con las ratas que ingirieron solo la solución de sacarosa, las ratas que ingirieron crónicamente la dosis alta (200 mg / 5 ml) de glicinamida, mostraron un alto UVCE (30%) significativamente (U= 5.5, p<0.05) el día siete. El cual decae del día 8 al 10. Las ratas que ingirieron la dosis de 100 mg / 5 ml, también mostraron un significativo efecto (U= 13.3, p<0.05) el día 7 decayendo desde el día 8 hasta el día diez. Mientras que, las ratas que ingirieron la dosis baja (50 mg/ 5 ml) de glicinamida solo mostraron un ligero efecto antinociceptivo, que no fue estadísticamente significativo. Siendo la dosis de 200 mg/ 5ml, la más efectiva en producir antinocicepcion que las dosis media y baja de la glicinamida ingerida crónicamente.
La figura 1B muestra el área bajo la curva que representa el efecto antinociceptivo total de la ingestión crónica de la glicinamida. El análisis de rangos de una vía con la Kruskal-Wallis reveló que la ingestión crónica de la glicinamida produjo un efecto antinociceptivo estadísticamente significativo (KW=9.8, grados de libertad 2, p<0.05). En comparación con la ingestión de la solución azucarada, ingestión de glicinamida crónica de la dosis media 100 mg/ 5 ml y alta de 200 mg / 5 ml indujo potente antinocicepcion durante el periodo de 7 días del experimento.
Figura 1
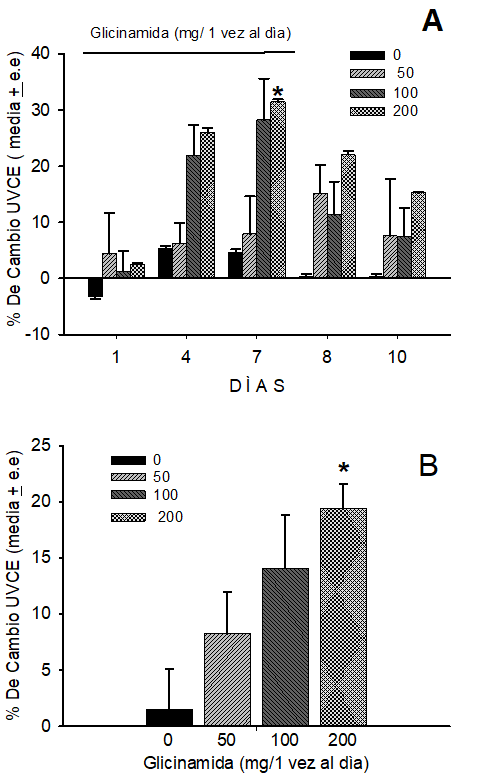
La figura 1A muestra el efecto de la ingestión una vez al día de la glicinamida sobre el UVCE. La figura 1B muestra el área bajo la curva que representa el efecto antinociceptivo total de la ingestión crónica. *=p<0.05, solución azúcar vs glicinamida 200 mg/5.
La figura 2A muestra el efecto de la ingestión dos veces al día de la glicinamida sobre el UVCE. El análisis con la prueba de Friedman de rangos de dos vías no mostro ningún efecto antinociceptivo durante la ingestión crónica de la glicinamida. Mientras que, el análisis con la prueba de Kruscal-Wallis mostró que la ingestión crónica de glicinamida dos veces por día produjo un efecto antinociceptivo significativo (KW=5.9, GL=2, p<0.05) el día 10. En comparación con las ratas que ingirieron crónicamente la solución de sacarosa por dos veces al día, las que ingirieron, la dosis alta (200 mg / 5 ml) de glicinamida se observó significativamente (U=7.0, p<0.05) alto UVCE de 22% el día 10. Tres días después de interrumpir el tratamiento. La ingestión de la dosis baja de glicinamida mostró un ligero efecto antinociceptivo similar al de las ratas que solo ingirieron la solución de sacarosa.
La figura 2B muestra el análisis de área bajo la curva que representa el efecto antinociceptivo total de la ingestión de glicinamida. El análisis de rangos de Kruskal-Wallis de una vía mostro que no hay un efecto antinociceptivo durante la ingestión crónica dos veces al día de la glicinamida.
Figura 2
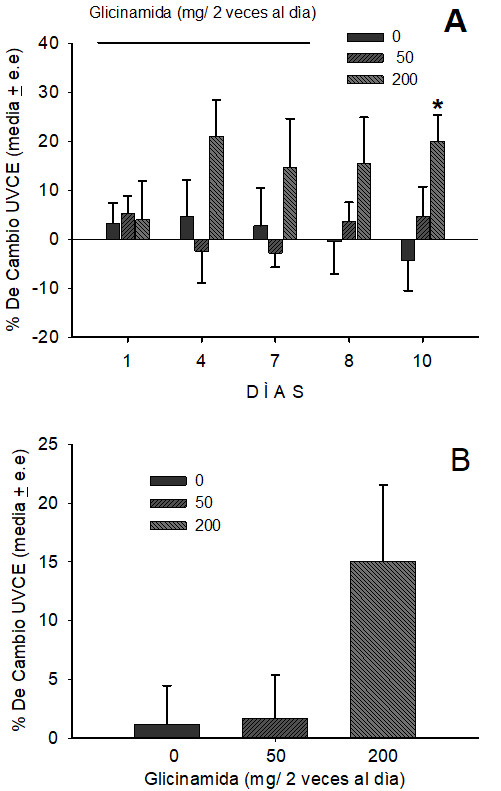
La figura 2A muestra el efecto de la ingestión dos veces al día de la glicinamida sobre el UVCE. La figura 2B muestra el análisis de área bajo la curva que representa el efecto antinociceptivo total de la ingestión de glicinamida. *= p<0.05, control vs glicinamida 200 mg /5 ml.
Los datos del presente estudio muestran que la ingestión crónica una vez al día de la glicinamida una vez al día, produce un efecto antinociceptivo desde el día 4 hasta el 8, que no es observado en las ratas que ingieren la glicinamida crónica dos veces al día. Parece que la doble ingestión al aumentar la dosis de glicinamida resulta en una acción de tipo inhibitorio. Como si los receptores de glicina fueran saturados, resultando en una falta de efecto de la glicinamida. Sin embargo, los datos indican que la glicinamida puede ser ingerida en la solución de sacarosa al 10 %. Además, de que la ingestión crónica de la glicinamida puede ser de utilidad para disminuir el proceso del dolor crónico.