
Actas del Congreso Nacional de
Tecnología Aplicada a Ciencias
de la Salud



Actas del Congreso Nacional de Tecnología Aplicada a Ciencias de la Salud Vol. 1, 2018
Gastroquina 1 (GKN1), se expresa abundantemente en la mucosa gástrica sana, pero se encuentra disminuida o ausente en tejido de cáncer gástrico. GKN1, contiene un dominio BRICHOS, un segmento COOH-terminal y una región NH2-terminal hidrofóbica. El dominio BRICHOS y la región NH2-terminal hidrofóbica reducen significativamente la viabilidad celular, la proliferación y formación de colonias de células de adenocarcinoma gástrico, por lo que se sugiere que ambas regiones presentan actividad supresora de tumor. El presente estudio se enfocó en la búsqueda de la mutación E104T en el dominio BRICHOS de GKN1. Se encontró que dicha mutación no está presente en las muestras analizadas de población guerrerense, sin embargo, es necesario aumentar el tamaño de muestra para confirmar estos hallazgos.
Palabras claves: Gastroquina 1, Mutación, Dominio BRICHOS
Gastrokine 1(GKN1), it is expressed abundantly in the mucous gastric healthy, but it found diminished or absented in tissue of gastric cancer. GKN1, contains a BRICHOS domain, a COOH-terminal segment and a NH2-terminal hydrophobic region significantly reduces the cellular viability, proliferation and formation of cell colonies the gastric adenocarcinoma, so it is suggested that both regions have tumor suppressor activity. The present study get focus on the mutation research E104T in the BRICHOS domain of GKN1. It founded which mutation is not present in the analyzed samples form guerrerense poblation, nevertheless, it is necessary increase the size of the sample to confirm this findings.
Keywords: Gatrokine1, Mutation, BRICHOS domine
El cáncer gástrico (CG) se forma en los tejidos que revisten el estómago, la mayoría comienza en las células de la capa interna del estómago (mucosa), que suele secretar moco [1] El CG es un adenocarcinoma del estómago que representa un 95% de los tumores malignos en este órgano [2]. En el 2012 el GLOBOCAN reportó 952,000 casos nuevos de CG (6.8% del total), colocándose como el quinto cáncer de mayor incidencia en el mundo y se reportaron 723,000 muertes al año, siendo la tercera causa de muerte por cáncer en el mundo [3]. Se ha observado una disminución continua en la prevalencia de CG durante las últimas décadas [4]. En México la tasa de mortalidad se redujo de 7.5 en el año 2000 a 5.6 en el 2012 [5]. Los factores asociados al desarrollo de CG son la ingesta elevada de sal y nitrato, una dieta baja en vitaminas A y C, el consumo de grandes cantidades de alimentos ahumados o curados y el agua de mala calidad [6]. La exposición al caucho y carbón también aumenta el riesgo, además del consumo de cigarrillos, la infección por Helicobacter pylori (H. pylori), por virus de Epstein-Barr, exposición a radiación y cirugía gástrica previa por enfermedad de úlcera benigna [7].
H. pylori es una bacteria Gram-negativa, patógena del tracto gastrointestinal y el principal agente etiológico de la gastritis crónica superficial y de úlcera péptica [8]. Esta bacteria coloniza exclusivamente los sitios gastrointestinales que cubren la mucosa gástrica [9,10] y provoca una respuesta inmune en el huésped, la infección se adquiere generalmente en la infancia y permanece presente durante toda la vida si no se trata con antibióticos [11]. H. pylori está altamente adaptado para colonizar el estómago humano, mientras que la mayoría de las otras bacterias no pueden colonizar persistentemente este nicho. Los principales factores que limitan la colonización bacteriana del estómago humano son: acidez, peristalsis, disponibilidad de nutrientes, respuesta inmune de hospedador y biota competitiva [12]. La infección por H. pylori, es uno de los principales factores de riesgo para el desarrollo de CG, se cree que la disminución de ciertas proteínas se asocia con este proceso canceroso, una de esas proteínas es GKN1.
Los miembros de la familia GKN; GKN1, GKN2 y GKN3, están localizados en el cromosoma 2p13.3 y dispuestos dentro de un intervalo genómico de 60 kb [13]. GKN1 es expresada principalmente en la mucosa gástrica, dicha expresión disminuye en el tejido gástrico infectado por H. pylori y no se ha encontrado en adenocarcinoma gástrico [14,15]. Los genes GKN codifican proteínas pequeñas de 181 a 184 aminoácidos, contienen un dominio BRICHOS, un segmento COOH terminal que muestra una divergencia considerable entre las distintas GKN y el péptido señal NH2-terminal hidrofóbico, cuyo procesamiento genera una proteína madura de aproximadamente 160 aminoácidos con una masa molecular de aproximadamente 18 kDa [13,16]
En 2002 Sánchez-Pulido et al., describieron, mediante el uso de herramientas bioinformáticas, el dominio BRICHOS, que consta de aproximadamente 100 aminoacidos, se denominó BRICHOS por las primeras letras de las proteínas Bri2 relacionadas con demencia familiar, condromodulina, relacionada al condrosarcoma y la proteína prosurfactante C (proSP-C), relacionada con el síndrome de dificultad respiratoria (SDR), se ha sugerido que las proteínas con dominio BRICHOS participan en diferentes procesos tales como tráfico intracelular y como chaperonas [17]. Hedlund et al., (2009) encontraron que el dominio BRICHOS está presente en más de 300 proteínas, divididas en 12 familias distantes, asociadas principalmente con demencia, síndrome de dificultad respiratoria y cáncer [16]. La familia de GKNs poseen un dominio BRICHOS y dos de ellas han sido asociadas con cáncer gástrico [18]. Se ha descrito que el dominio BRICHOS mantiene una estructura conservada en mayor grado en la región NH2-terminal, en comparación con la COOH-terminal, por lo que pocas variaciones suelen estar presentes en dicha región [16]. Existen reportes de mutaciones en diferentes genes de proteínas que poseen dominio BRICHOS, por ejemplo, las mutaciones en los genes Bri2 y proSP-C dan lugar a demencia familiar e enfermedad pulmonar intersticial (ILD), respectivamente [19,13]. En células de cáncer de mama se describió una mutación, que implica el cambio de ácido glutámico (E) por treonina (T), en la posición 104 de GKN1 (E104T) [20]. Es probable que esta mutación esté relacionada con la pérdida de la expresión de GKN1 en cáncer gástrico, sin embargo, aún no existen estudios que documenten la presencia de la mutación E104T en pacientes con gastritis crónica y cáncer gástrico. El objetivo del presente trabajo fue analizar la frecuencia de la mutación E104T en el dominio BRICHOS de GKN1 en pacientes con gastritis crónica, cáncer gástrico y personas asintomáticas.
Selección de muestras: Se seleccionaron muestras de DNA del Biobanco de DNA del Laboratorio de Investigación Clínica de la Facultad de Ciencias Químico Biológicas, de la Universidad Autónoma de Guerrero, provenientes de pacientes originarios del estado de Guerrero con diagnóstico endoscópico e histopatológico de gastritis crónica, cáncer gástrico y personas asintomáticas.
Identificación de la mutación E104T en el dominio BRICHOS de GKN1: Se diseñó un juego de iniciadores para amplificar por PCR un fragmento de DNA del exón 4 del gen de GKN1 en donde se ha reportado que se encuentra la mutación E104T. Los productos de PCR, fueron sometidos a electroforesis en geles de agarosa a 1.5% los cuales fueron teñidos con bromuro de etidio y vizualizado con luz UV en un transiluminador (BIO-RAD) (Figura 1). Los productos de PCR fueron marcados utilizando el Kit Big Dye terminator 3.1 (Applied Biosystems Warrington, UK) de acuerdo a las indicaciones del fabricante. La purificación de los productos marcados se realizó con el método manual de purificación con Isopropanol al 75%, para posteriormente ser secuenciados en un secuenciador ABI PRISM 310 GENETIC ANALYZER (Applied Biosystems, California, EE.UU.). Todas las secuenciadas obtenidas fueron analizadas en el software Finch TV, en el cual se obtuvieron electrofelogramas que muestra los nucleótidos por colores. Posteriormente las secuencias fueron alineadas en el software online LALIGN (https://embnet.vital-it.ch/software/LALIGN_form.html), con la secuencia de referencia del gen GKN1 (NC_000002.12:68974573-68980980 Homo sapiens chromosome 2, GRCh38.p7) donde es posible identificar si existe la presencia de la mutación E104T (codón GAA) o algún cambio puntual en la secuencia nucleotídica del exón 4.
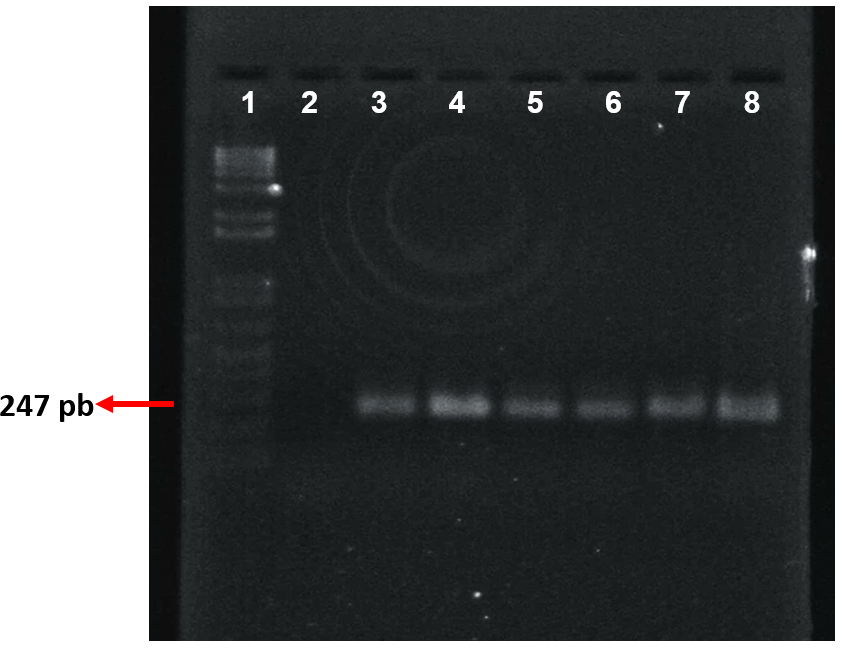
Figura 1. Amplificación de muestras clínicas, mediante PCR punto final. Se muestra la electroforesis de la PCR de muestras clínicas. Carril 1 MPM 1Kb plus; Carril 2, control negativo; Carril 3 y 4, muestras de pacientes con cáncer gástrico; Carril 5 y 6, muestras de pacientes con gastritis crónica; carril 7 y 8, muestras de personas asintomáticas. Una banda de 247 pb correspondiente a la secuencia amplificada de GKN1
De los pacientes incluidos en el estudio, el 52% (13/25) fueron hombres y el 48% (12/25) mujeres, con un rango de edad de 16 a 89 años. La frecuencia general de H. pylori fue del 44% (11/25); 37.5 % (3/8) en pacientes con gastritis crónica, 33.3% (3/9) en cáncer gástrico y 62.5% (5/8) en personas asintomáticas (Tabla 1).
Tabla 1. Características generales e infección por H. phylory en personas asintomáticas y pacientes con gastritis crónicas y cáncer gástrico
| Características | Asintomáticos n=8 |
Gastritis crónica n=8 |
Cáncer gástrico n=9 |
Total n=25 |
|
|---|---|---|---|---|---|
| Edad |
|
|
|
|
|
|
20 a 39 años | 4 (50%) | 0 | 3 (33%) | 7 (28%) |
|
40 a 59 años | 4 (50%) | 2 (25%) | 1 (11%) | 11 (44%) |
|
> de 60 años | 0 | 6 (75%) | 5 (56%) | 11 (44%) |
| Género n (%) | |||||
|
Femenino | 2 (25%) | 3 (37%) | 5 (80%) | 10 (40%) |
|
Masculino | 6 (75%) | 5 (63%) | 4 (20%) | 15 (60%) |
| Habito de fumar n (%) | |||||
|
No | 4 (50%) | 5 (63%) | 5 (80%) | 14 (56%) |
|
Si o fumaba | 4 (50%) | 3 (37%) | 4 (20%) | 11 (44%) |
| Consumo de alcohol n (%) | |||||
|
No | 1 (12%) | 2 (25%) | 5 (80%) | 14 (56%) |
|
Si o consumia | 4 (50%) | 3 (37%) | 4 (20%) | 17 (68%) |
| Antecedentes familiares con sintomatología gástrica similar (%) |
|||||
|
No | 4 (50%) | 7 (88%) | 5 (80%) | 8 (32%) |
|
Si | 4 (50%) | 1 (12%) | 4 (20%) | 9 (64%) |
| Infección por H. pylori (%) | |||||
|
Negativo | 3 (38%) | 5 (63%) | 6 (67%) | 14 (44%) |
|
Positivo | 5 (62%) | 3 (37%) | 3 (33%) | 11 (44%) |
El análisis de las secuencias mostró que no existen mutaciones.
De las 25 muestras incluidas en este estudio, ninguna presentó la mutación E104T (Tabla 2). Adicionalmente, se analizó la secuencia completa del exón 4 de GKN1 en donde tampoco no se encontró ninguna mutación (Figura 2).
Tabla 2 Frecuencia de la mutación E104T en personas asintomáticas y pacientes con gastritis crónica y cáncer gástrico
| Mutación E104T | Asintomáticos n=8 |
Gastritis crónica n=8 |
Cáncer Gástrico n=9 |
Total n=25 |
|---|---|---|---|---|
| E104 | 100% | 100% | 100% | 100% |
| T104 | 0 | 0 | 0 | 0 |
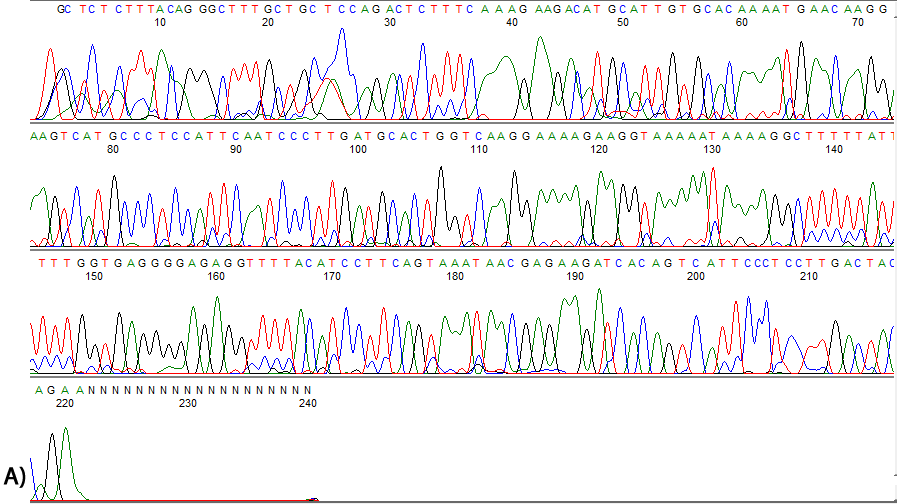

Figura 2. Análisis de secuencia del exón 4 de GKN1. A. Se muestra el electroferograma de una muestra con diagnóstico de gastritis crónica, en la cual no se observan mutaciones. Los nucleótidos se identifican por colores; rojo para Timina, Azul para Citosina, negro para Guanina y verde para Adenina. B. Alineamiento de la secuencia obtenida con la secuencia de GKN1, utilizando el software online LALING, para identificar las variaciones nucleotídicas. Se identifica la región 104 del exón 4 y se ubica el codón GAA del aminoácido E (ácido glutámico). Se observa que no existe la mutación E104T (cambio de un ácido glutámico por una treonina)
En pacientes con gastritis crónica, cáncer gástrico y en personas asintomáticos originarios del estado de guerrero, no se encontró la mutación E104T en el dominio BRICHOS de GKN1.
La investigación se realizó con financiamiento otorgado por el CONACyT, convocatoria Ciencia Básica CB-2015-01 y por la Secretaria de Educación Pública, a través del programa para el Apoyo a la incorporación del nuevos/as profesores/as de tiempo completo, convocatoria 2017.