
Actas del Congreso Nacional de
Tecnología Aplicada a Ciencias
de la Salud



Actas del Congreso Nacional de Tecnología Aplicada a Ciencias de la Salud Vol. 2, 2019
Se presenta el análisis teórico de la resistencia que ofrecen los principales componentes de las placas de ateroma, respecto a sus propiedades mecánicas y las fuerzas con las que estos se unen entre sí, al ser comparada con la fuerza de desgaste calculada del modelo de cavitación propuesto al emplear los parámetros de un transductor ultrasónico comercial. El rango de fuerzas de adhesión de las células analizadas fue de 0,3mN a 50pN y el Módulo de Young fue de 50Pa a 9GPa. Se empleó una presión de entrada de 8MPa. Las fuerzas liberadas por la explosión de una burbuja fueron de 0,063mN a 14pN y el esfuerzo aplicado 1,2Pa a 11,49GPa.
Palabras claves: ateroma, cavitación, ultrasonido
We present the theoretical analysis of the resistance offered by the main components of the atheromatous plates, respect to their mechanical properties and joining forces, when compared to the calculated wear force of the proposed cavitation model using the parameters of a commercial ultrasonic transducer. The range of adhesion forces of the cells analyzed was 0.3mN to 50pN and the Young Module values were 750Pa to 9GPa. An inlet pressure of 8MPa was used. The forces released by the explosion of a bubble were 0.063mN at 14pN and the effort applied 1.2Pa to 11.49GPa.
Key words: atheroma, cavitation, ultrasound
La aterosclerosis consiste en la malformación de las arterias a causa de la acumulación excesiva de material lipídico. Causa la mayoría de las afecciones cardio y cerebro-vasculares [1], las cuales representan sus principales síntomas clínicos y causas de muerte de las últimas décadas [2]. La aterosclerosis suele detectarse en las últimas etapas donde la amputación del tejido estenótico es inminente, la mayoría de los tratamientos son remediales e invasivos, p. ej.: angioplastia, aterectomía y colocación de prótesis [3]–[9].
En México el costo de una intervención por angioplastia oscila entre cien y trescientos mil pesos y puede incrementar hasta más de un millón al presentarse cualquier otro tipo de complicación [10]. Una estrategia para disminuir los altos costos de los tratamientos para remover la aterosclerosis es globalizar las técnicas empleadas para su remoción, las cuales surgen de la diversidad de características fisiológicas que presenta las placas de ateroma y su localización [11]. Las tendencias actuales para el desarrollo de nuevos tratamientos son remplazar los procedimientos quirúrgicos por técnicas menos agresivas [12]. Las cuales empleen efectos magnéticos [13], sónicos [14] y luminosos [15].
El empleo de ondas ultrasónicas llama en especial la atención debido a que no ionizan a los electrones a su paso a través de los tejidos, además, de que permite el diagnostico. Se emplea en distintas aplicaciones médicas, tales como: la eliminación de diferentes malformaciones en el cuerpo [16]; administración de medicamentos [17]; sonoforesis [18];disolución de trombos [19]; extracción de sustancias de los tejidos [20].
La terapia con ultrasonido (US) se da principalmente con ondas focalizadas o pulsadas, lo cual implica diversas consecuencias en los tejidos [21]. Como los efectos de la propagación de US son amplios, por tal motivo, el objetivo de este estudio teórico es visualizar la relación de desgaste ocasionada por la cavitación de la sangre respecto a la resistencia mecánica de los principales componentes de las placas de ateroma al emplear los parámetros de entrada de un transductor US comercial.
La cavitación es un fenómeno producido por la formación y colapso de burbujas de vapor en la superficie de un contendor debido a cambios significativos en la presión hidrostática [22]. Es el resultado de la nucleación de la fase liquida e inicia por la formación pequeños clústers de una fase de vapor en la fase liquida. Existen dos formas en que ocurre: homogénea y heterogénea. La primera ocurre al azar, pequeños grupos de una nueva fase surgen espontáneamente dentro de la fase metaestable original y la segunda ocurre a partir de sitios preferenciales debido a impurezas en los materiales [23] o inestabilidades en la corriente de un fluido donde la densidad y presión no son uniformes [24].
Debido a la dinámica de los fluidos en este trabajo se considera el análisis de la cavitación de forma homogénea. Se emplea el análisis de la teoría clásica de nucleación (TCN) [25] para describir el fenómeno de cavitación. Con el fin de describir la nucleación, se calcula el cambio en la energía libre de Gibbs para la condensación de n moles de vapor a una presión de vapor P en una gota, el cual, resulta de la diferencia entre la energía libre de la fase de vapor menos la energía de la fase líquida GV - GL.Donde GV está dada por:
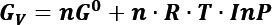
Suponiendo que el vapor se comporta como un gas ideal, GL es igual a la energía libre de Gibbs de un vapor (hipotético) en equilibrio con la gota de líquido. Este vapor hipotético tiene una presión ![]() , su energía libre de Gibbs se define como:
, su energía libre de Gibbs se define como:
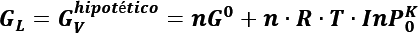
Cuando las gotas tienen una superficie curva de radio r, la presión de vapor ![]() es mayor que la de la superficie del líquido plano. La diferencia en las energías de Gibbs considerando que la gota tiene una tensión superficial es:
es mayor que la de la superficie del líquido plano. La diferencia en las energías de Gibbs considerando que la gota tiene una tensión superficial es:
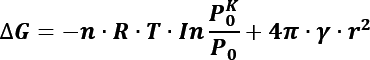
En una gota de radio r hay 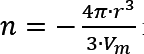 moles, Vm es el volumen molar de la fase líquida. Por tanto:
moles, Vm es el volumen molar de la fase líquida. Por tanto:
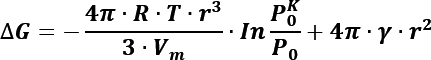
Este es el cambio en la energía libre de Gibbs en la condensación de una gota a partir de una fase de vapor con presión parcial P. En la Figura 1 se muestran las variaciones en la energía ΔG cuando se incrementa el tamaño del radio r. De acuerdo con la teoría clásica de nucleación, la energía necesaria para formar un núcleo de radio r es la suma de la contribución de la superficie y la contribución de la masa desplazada.
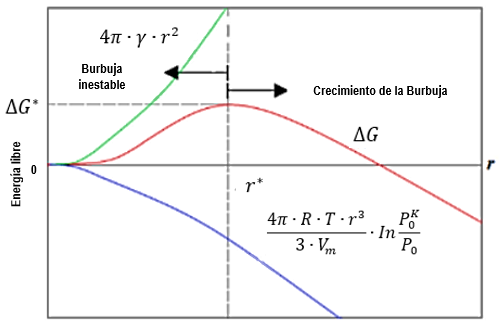
Figura 1: Energía de nucleación como función del radio. Solo burbujas de radios mayores al crítico son estables y crecen [26]
Por otra parte, sí se analiza la ecuación (4) con mayor detalle, para 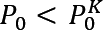 , el primer término es positivo y por lo tanto ΔG es positivo. Cualquier gota formada por moléculas de agrupamiento al azar se evapora. Este proceso puede ocurrir aún sin condensación. Para
, el primer término es positivo y por lo tanto ΔG es positivo. Cualquier gota formada por moléculas de agrupamiento al azar se evapora. Este proceso puede ocurrir aún sin condensación. Para ![]()
![]() , ΔG aumenta al aumentar el radio y tiene un máximo en el radio r* crítico. En el máximo se tiene que
, ΔG aumenta al aumentar el radio y tiene un máximo en el radio r* crítico. En el máximo se tiene que 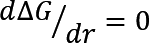 , lo que conduce a un radio crítico de:
, lo que conduce a un radio crítico de:
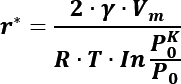
La energía critica del sistema se alcanza para el crecimiento de la burbuja se alcanza cuando r = r*, la cual se expresa a continuación [27].
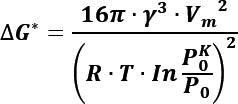
La tasa de nucleación representada por J se define por el número de burbujas formadas en un sistema homogéneo por unidad de tiempo y volumen, respecto a la barrera de energía libre (energía de Gibbs) requerida para que estos crezcan, que se expresa como:
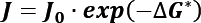
La tasa de nucleación se aproxima a la probabilidad de formación de una cierta cantidad de núcleos (de cualquier tamaño), definida por la siguiente expresión. Donde J0 es un factor de proporcionalidad, se calcula a partir de:
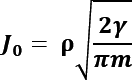
donde “ρ” es la densidad numérica del líquido (moléculas/m3) y “m” es la masa de una molécula, [28]. Un valor típico de J0 para el caso de nucleación homogénea extraído de la literatura para temperaturas cercanas a los 300°K es de J0=425 cm-3 s-1 [29]. Gracias a la velocidad y teniendo en cuenta la resistencia mecánica de los materiales se puede calcular el nivel de desgaste a causa del fenómeno de cavitación.
Las placas de ateroma son materiales compuestos laminados, que se subdividen en otro tipo de materiales compuestos, transpuestos los unos con los otros. Presentan un elemento matriz (p. ej. matriz extracelular) y elementos de refuerzo en forma de fibras (p. ej. fibras de colágeno, elastina, la unión de varias células, como en el caso del endotelio y el tejido muscular) y/o particulado (p. ej. células o partículas aisladas) [30]. El modelo de análisis propuesto para conocer la resistencia mecánica de los tejidos ante perturbaciones externas es calculando la resistencia mecánica de sus elementos corpusculares y la forma en que interactúan entre sí. En este trabajo se investigarán las propiedades mecánicas de un grupo seleccionado de elementos considerados como los principales integrantes de las placas de ateroma y las fuerzas en que estos se unen entre sí. La representación y la abreviatura de los elementos se muestra en la Figura 2.
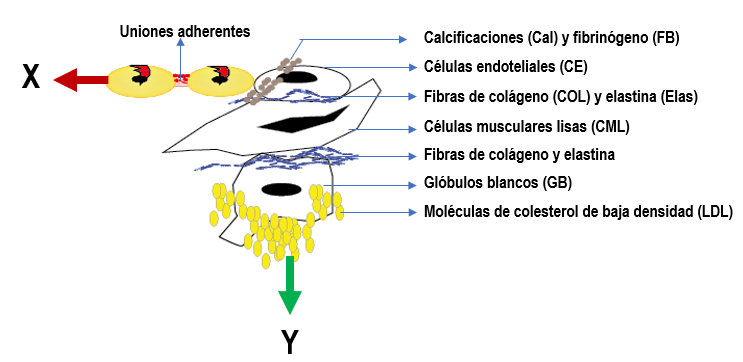
Figura 2: Caso de agrupamiento de los principales componentes de las placas de ateroma
Por otra parte, el modelo de la aplicación de US consiste en calcular la fuerza de desgaste que se libera tras la explosión de diferentes tamaños de burbuja por los cambios de presión. El esquema de análisis propuesto se ilustra en la Figura 3 en donde una fuente de US genera un cambio de presión que a una determinada distancia, la cual no se calculó, provoca la formación de una burbuja, representada por Pv, que al impactar en el tejido pueda romper el citoplasma de las células que contiene y las fuerzas de enlace con las que se unen. En la figura h representar el diámetro de las células F la fuerza, ∆P el cambio de presión y A el área de impacto de la burbuja.
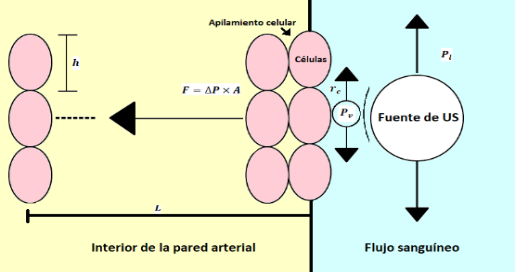
Figura 3: Esquema representativo del modelo de cavitación
Al despejar ![]() de la ecuación de tamaño crítico (5) se encuentra la presión de la burbuja:
de la ecuación de tamaño crítico (5) se encuentra la presión de la burbuja:
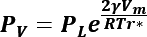
Donde, por conveniencia 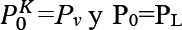 . A partir de la presión que alcanza la burbuja al formarse se puede calcular la fuerza liberada a causa del intercambio de presión alcanzada considerando un área de impacto máxima. Los parámetros que se emplearán para los cálculos requeridos del modelo de cavitación se enlistan a continuación en la Tabla 1. Por sencillez del modelo se desprecian los efectos de la dinámica de los fluidos, la liberación de calor y la mecánica de contacto, lo cual podría estudiarse en trabajos futuros. Los valores que se obtendrán del modelo presentado son:
. A partir de la presión que alcanza la burbuja al formarse se puede calcular la fuerza liberada a causa del intercambio de presión alcanzada considerando un área de impacto máxima. Los parámetros que se emplearán para los cálculos requeridos del modelo de cavitación se enlistan a continuación en la Tabla 1. Por sencillez del modelo se desprecian los efectos de la dinámica de los fluidos, la liberación de calor y la mecánica de contacto, lo cual podría estudiarse en trabajos futuros. Los valores que se obtendrán del modelo presentado son:
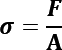
donde F representa a la fuerza obtenida para cada valor de r* y A el área de impacto.
Tabla 2: Propiedades adhesivas de los componentes propuestos
| Datos | Magnitud |
|---|---|
| PL1=Presión del sensor ultrasónico, [31] | 8MPa |
| Temperatura °K | 310,15°K |
| R=Constante de Boltzmann | 8,314472 J/°K*mol |
| G=Gravedad | 9,81 m/s2 |
| J0=Coeficiente de nucleación | J0=431 m-3 s-1 |
| TS=Tensión superficial de la sangre | 52 x10-3N/m |
| n=Partículas de agua | 1,80 x10-2 kg/mol |
| ros=Densidad de la sangre | 1005 kg/m3 |
| r1*= Propuesta de radio de burbuja | 5x10-3 |
| r2*= Propuesta de radio de burbuja | 5x10-3 |
| r3*= Propuesta de radio de burbuja | 5x10-4 |
| r4*= Propuesta de radio de burbuja | 5x10-5 |
| r5*= Propuesta de radio de burbuja | 5x10-6 |
| r6*= Propuesta de radio de burbuja | 5x10-7 |
| r7*= Propuesta de radio de burbuja | 5x10-8 |
| r8*= Propuesta de radio de burbuja | 5x10-9 |
| r9*= Propuesta de radio de burbuja | 5x10-10 |
| r10*= Propuesta de radio de burbuja | 5x10-10 |
| A= área de impacto | A=πr2 |
Las fuerzas de adhesión de los elementos considerados dependen de los ligandos con los que se unen [32]. Los valores encontrados se muestras en la Tabla 2.
Tabla 3: Características de elementos seleccionados
| Elemento | Tamaño | Peso | Módulo de Young |
|---|---|---|---|
| GR-FB | Peso | 1,83x10-10 | [33] |
| GB-CE | P- Selectina (100mn) | 1,65 x10-10 | [34] |
| Col-CML | Diversas integrinas | 3,22 x10-4 | [35] |
| LDL-Col | - | 7 x10-4 | [36] |
| Col-Elas | - | 2,35 x10-8 | [37] |
| GB-CE | a4b1 / VCAM-1 | 5, x10-11 | [38] |
| CE-Células cancerígenas | ICAM-1 | 20-70 x10-12 | [39] |
Observaciones de los datos recolectados:
Las propiedades físicas de los elementos seleccionados se muestran en la Tabla 3. Las fibras de COL tienen mayor rigidez y las CE son las menos rígidas.
Tabla 3: Características de elementos seleccionados
| Elemento | Tamaño | Peso | Módulo de Young | Tipo de estudio |
|---|---|---|---|---|
| CE | D=1 μm [40] | 10-20pg [40] | 750Pa [41] | AFM |
| CM | 100*40*30μm [42] | 12μg [42] | 30KPa [42] | Teórico |
| GB | 10-30μm [43] | 6μg, [44] | ~40KPa- 70MPa [44] | AFM |
| LDL | 20-10nm [49] | 300-800kDa [48] | 0.1–2MPa [45] | AFM |
| FB | D=120-610nm [49] | 340KDa [49] | 0.01–0.4MPa [49] | Electrospinning |
| COL | Tropocolageno: ~L=300nm | 1,3KDa o 2,1587e-21g [50] | Fibra:~3 y 9GPa [51] | X-Ray, Teórico |
| ELAS | Monómero:D≈1,5nm [52], L≈11-15nm [53] | ~60-68KDa o ~1 x10-19g [52], [54], [55] | ~3kPa [55] | AFM |
| CAL | D=1,5μm [56] | 3,14 g/cm3 [57] | 0,5MPa [58] | Teórico |
Los valores obtenidos no son exactos, pero dan un rango de análisis para estimar el comportamiento de las propiedades individuales de los elementos. Al final se puede observar que el rango de fuerzas de adhesión de las células analizadas es de 0,3mN a 50pN y los valores de Módulo de Young de estas oscilan entre 750Pa y 9GPa.
Empleado el modelo de cavitación los datos obtenidos para los radios de burbuja seleccionados se muestran en la Tabla 4.
Tabla 4. Resultados del modelo de cavitación
| r | r* | PV MPa |
A m2 |
Fuerza | Energía | TN m-3 s-1 |
σ °Pa |
| 1 | 5mm | 8,39 | 5,24x10-5 | 63,5µN | 1,96KJ | 6,79 x108 | 1,212 |
| 2 | 1mm | 8,39 | 2,09x10-6 | 12,7µN | 391 | 1,12Ex1027 | 6,06 |
| 3 | 0,5mm | 8,39 | 5,24x10-7 | 6,35µN | 196 | 2,11x1029 | 12,12 |
| 4 | 50µm | 8,39 | 5,24x10-9 | 0,635µN | 19,6 | 2,37x1031 | 121,2 |
| 5 | 5µm | 8,39 | 5,24x10-11 | 63,5nN | 1,96 | 3,80x1031 | 1212 |
| 6 | 0,5µm | 8,40 | 5,24x10-13 | 6,35nN | 0,196 | 3,98x1031 | 1,213x104 |
| 7 | 50nm | 8,51 | 5,24x10-15 | 0,639nN | 19,6mJ | 4x1031 | 1,221 x105 |
| 8 | 5nm | 9,69 | 5,24x10-17 | 68,3pN | 1,96mJ | 4x1031 | 1,304 x106 |
| 9 | 0,5nm | 0,356 | 5,24 10-19 | 14,2pN | 0,196mJ | 4x1031 | 2,719 x107 |
| 10 | 0,1nm | 11500 | 2,09x10-20 | 0,241pN | 39,1µJ | 4x1031 | 1,149 x1010 |
Los valores a partir de la presión se calcularon de una expresión logarítmica, por lo que los cambios se notan a partir de incrementos significativos en los parámetros seleccionados. Las fuerzas liberadas por la explosión de una burbuja alcanzaron una fuerza de desgaste de 0,063mN a 14pN y el esfuerzo que una sola burbuja puede imprimir oscila entre 1,2Pa a 11,49GPa. Fuerza suficiente para romper las paredes citoplasmáticas de las células considerando los módulos de Yong encontrados en la literatura mostrados en la Tabla 3.
Los resultados son factibles para aplicar el modelo de cavitación en un diseño experimental, tal como se representa en la Figura 4.
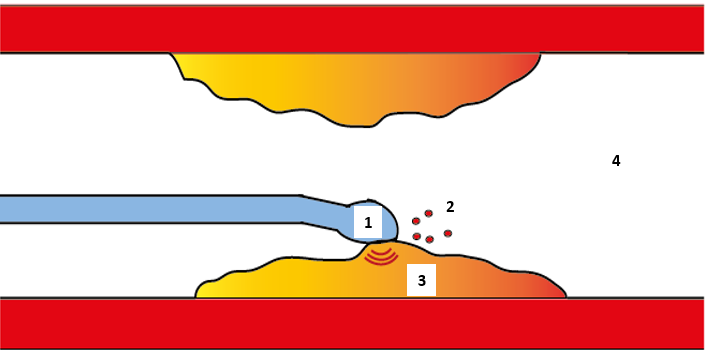
Figura 4: Representación de la aplicación de terapia física del ultrasonido por medio de un catéter para angioplastia
En 1 se observa un catéter con US, 2 es el material desprendido que es proporcional a r*, 3 placa de ateroma, 4 flujo sanguíneo. La técnica propuesta se recomienda para placas calcificadas considerando que estas emiten menores cantidades de fibrinógeno activo al torrente sanguíneo [60] y el material desprendido se puede recolectar por medio de algún otro dispositivo, p ej. [61]. Es necesario estudiar la relación entre la respuesta inmunológica y el desprendimiento de material. La aplicación de US al existir placas vulnerables [59] podría ser al aplicar ultrasonido focalizado para evitar dañar el endotelio sano y estimular la respuesta inmunológica.
El rango de fuerza emitido por el transductor seleccionado es prometedor ya que como mínimo rompe todos los valores de fuerza calculados. No obstante, para menores tamaños de burbuja el potencial destructivo es mayor debido en primera instancia al incremento en la TN y al esfuerzo realizado para romper las células contenidas en los tejidos.
El modelo de análisis sirve de ejemplo para analizar la resistencia de otros tejidos, como la formación de tumores, abscesos y otras malformaciones. No sólo de US si no para usar otras técnicas de remoción de la aterosclerosis y sus síntomas. Sin embargo, la ventaja competitiva del US es que ofrece la posibilidad de dar terapia física y la toma de imágenes en tiempo real. Las limitantes de la implementación de esta tecnología se deben principalmente a la resolución de la toma de imágenes, procesamiento, sensibilidad y modulación de los transductores empleados hoy en día.