
Actas del Congreso Nacional de
Tecnología Aplicada a Ciencias
de la Salud



Actas del Congreso Nacional de Tecnología Aplicada a Ciencias de la Salud Vol. 2, 2019
La celulosa bacteriana (CB) es un polisacárido producido por un bacterias aerobias y levaduras, tales como Gluconacetobacter y Acetobacter. Por sus propiedades la CB ha sido ampliamente recomendada como biomaterial en el campo médico, además su estructura puede ser modificada mediante la adición de otros componentes. Este trabajo desarrolló un sistema de co-cultivo de bacterias formadoras de CB y microalgas inmovilizadas (AI) en alginato (Desmodesmus sp.) con la finalidad de optimizar el suministro de oxígeno. Además, en uno de los experimentos se incorporó gel aloe vera (3%) para modificar las propiedades finales de la CB. Se obtuvo alta producción de biomasa húmeda (5.7 gr.) en presencia de AI y gel de aloe vera. No obstante, se observaron cambios en la coloración de las microalgas, por lo tanto, es necesario modificar el medio de cultivo para no afectar la fisiología de las microalgas.
Palabras claves: Cocultivo, Inmovilización, Alginato, SCOBY
Bacterial cellulose (CB) is a polysaccharide produced by aerobic bacteria and yeasts, such as Gluconacetobacter and Acetobacter. Due to its properties, CB has been widely recommended as a biomaterial in the medical field, also their structure can be modified by addition of other components. This work developed a system of co-culture of CB-forming bacteria and immobilized microalgae (AI) in alginate (Desmodesmus sp.) in order to optimize the oxygen supply. In addition, one of the experiments incorporated aloe vera gel (3%) to modify the final properties of the CB. High production of biomass (5.7 gr.) was obtained in the presence of AI and aloe vera gel. However, changes in the coloration of the microalgae were observed, therefore, it is necessary to modify the culture medium so as not to affect the physiology of the microalgae.
Keywords: Co-Culture, Immobilization, Alginate, Scoby
La celulosa bacteriana (CB) es un biopolímero de apariencia gelatinosa y translucida formada por microfibras de celulosa (β-D – unidades de glucosa). Es producida de manera extracelular por diversos géneros de bacterias gran negativas como: Gluconacetobacter, Acetobacter, Agrobacterium, Achromobacter, Aerobacter, Sarcina, Azobacter, Rhizobium, Pseudomonas, Salmonella y Alcaligenes, entre la que destaca Gluconacetobacter como la mejor productora. Se ha demostrado que la implementación de levaduras mejora la producción de CB, creando el SCOBY (simbiotic cultivo of bacteria and yeast) [1].
La CB, en comparación con la celulosa vegetal, tiene baja densidad, alta fuerza tensil, alto grado de cristalinidad (80-90%); en estado húmedo es porosa y es relativamente permeable a los gases. Además, por su alta pureza, su capacidad de retención del agua es un biomaterial con enorme potencial en el área médica [2]. No obstante, la CB carece de efecto antimicrobiano, conductividad, antioxidante que limitan su aplicación, pero son solventadas mediante la adición de otros compuestos durante el cultivo lo cual amplifica su empleo [3,4].
Comúnmente, para la CB se obtiene medios de cultivo como: BEGG, infusión de té negro o verde, agua de coco) sumado a los siguientes requerimientos ambientales: oxígeno, temperatura (20 – 30 °C), pH entre 3 y 4 [5,11]. Se han reportado diversos métodos de cultivo, tales como el cultivo estático y el dinámico, los cuales modifican morfológicamente el producto final [6,12].
Desde hace más de veinte años, la técnica de co-cultivo surgió como un método en la que se permite el crecimiento de dos (o más) especies en conjunto con la finalidad favorecer la producción celular objetivo o la síntesis de algún compuesto de interés [6,9,10]. En estos sistemas se han empleado microalgas en co-cultivos con levaduras (Rhudotorula glutinis) y bacterias (Dinoroseobacter shibae), donde las algas suministran el O2 para los organismos heterótrofos que a su vez proveen de CO2 requerido para las algas [7,8,11].
Con base en lo anterior, este trabajo tuvo como objetivo la obtención de celulosa bacteriana en un sistema de co-cultivo con algas inmovilizadas en esferas de alginato, así mismo, identificar si el gel de aloe vera la producción de biomasa húmeda de CB.
a. Inmovilización de microalgas
La cepa Desmodesmus sp (Chlorophyta) fue aislada de la reserva ecológica del Pedregal de San Ángel, UNAM y se cultivaron en medio BBM en matraces de 250 mL en las siguientes condiciones de laboratorio: temperatura 29 °C; intensidad luminosa: 95 µmoles s-1 fotoperiodo: 12:12 horas luz: obscuridad. Los cultivos se mantuvieron en condiciones de esterilidad.
Para la inmovilización del cultivo de Desmodesmus se siguió la metodología descrita en [ cita] Ponce et. al. 2019 la cual consistió en la elaboración de una solución de alginato de sodio (3%) en H2Od, la cual fue calentada a 60 °C en agitación constante en una parrilla (Corning PC 420D) hasta su completa disolución. La mezcla se dejó enfriar a temperatura ambiente. A la solución de alginato se le agregaron 10 ml de cultivo concentrado de microalgas. El concentrado de microalgas se obtuvo mediante un previo cultivo de algas (Desmodesmus sp.).
Para la elaboración de las esferas de alginato se empleó una solución de CaCl2 al 2%, en las que se vertieron gotas de la mezcla de alginato con una pipeta Pasteur estéril. Las esferas resultantes fueron medidas con un vernier.
Elaboración de medio de cultivo para la obtención de CB
Se prepararon 1,800 ml de medio de cultivo de infusión de té negro con las siguientes proporciones: té negro (6 gr/L), azúcar de mesa (114.0 gr/ L). El pH se ajustó con ácido acético glacial hasta alcanzar un pH de 3 - 4. Se midieron los grados Brix (BX) con el refractómetro (ATAGO 1T).
Establecimiento de co-cultivos
Se realizaron cuatro tipos de cultivo en réplica de tres de acuerdo con la nomenclatura que se presenta en la Tabla 1.
Tabla 1. Nomenclatura del diseño experimental
| Tipo de cultivo | Clave |
|---|---|
| Cultivo control | C |
| SCOBY + Aloe vera | SAV |
| SCOBY + Algas inmovilizadas | SA |
| SCOBY + Algas inmovilizadas + Aloe vera | SAAV |
Se agregaron 150 mL de infusión de té a frascos de cristal previamente esterilizados, todos los cultivos fueron inoculados con 1.5 ml de inóculo de SCOBY. El tipo de cultivo C únicamente contenía el inóculo de SCOBY; el cultivo SAV se le adicionó 5 ml gel aloe vera natural; el SA se añadió 100 esferas de algas inmovilizadas y finalmente el SAAV se le adicionó 100 esferas de microalgas y además 5 ml de gel de aloe vera natural.
Los cultivos se mantuvieron en el laboratorio de microalgas de la Universidad Iberoamericana Puebla a temperatura ambiente (23 °C); intensidad luminosa de 95 µmoles m-2 s-1 en un fotoperiodo de 12h:12h / luz: obscuridad simulando un ambiente natural de un ciclo circadiano. Los cultivos se revisaron diariamente y fueron mantenidos por un periodo de tres semanas.
Al finalizar la fase de experimentación, las esferas de algas inmovilizadas se les realizaron un corte transversal y fueron revisadas en un microscopio estereoscópico (Leica EZ4) y un microscopio óptico (Leica DM 500) con la finalidad de comprobar el estado de las microalgas
La CB húmeda fue pesada y medida, las muestras fueron deshidratadas por 24 horas en el invernadero de microalgas. Se obtuvieron los pesos secos de la CB (tabla 2).
El mayor grosor y peso húmedo de la CB se observó en el cultivo C que obtuvo valores promedio de 6.9 mm y 22.6 gr respectivamente. Contrariamente el cultivo SA presentó los valores más bajos (2.2 mm y 6.5 gr.) (Tablas 2). No obstante, de estos valores no solo indican el valor de la biomasa si no también la cantidad de agua retenida. El cultivo SAAV fue el que mayor producción de biomasa seca obtuvo (2.0 gr).
Tabla 2. Promedios de grosor, peso húmedo y peso seco de la CB
| Tipo de cultivo | Grosor (mm) |
Peso húmedo (gr) |
Peso seco (gr) |
|---|---|---|---|
| C | 6.9 ±1.9 | 22.6 ± 6.1 | 1.9 ± 0.2 |
| SAV | 3.0 ± 0.6 | 8.7 ± 2.1 | 0.8 ± 0.1 |
| SA | 2.3 ± 0.3 | 6.5 ±1.4 | 1.0 ± 0.1 |
| SAAV | 5.7 ±0.7 | 19.5 ± 2.7 | 2.0 ± 0.3 |
Durante la fase de experimentación se observaron cambios en la coloración de las esferas con algas inmovilizadas, en la etapa inicial fue verde brillante (Fig. 1 a) y al final se presentaron tonalidades amarillentas (Fig. 1 c). Lo cortes transversales reflejaron que las células de microalgas perdieron su integridad, al sufrir daños en sus paredes celulares. Estos cambios se atribuyen a dos posibles factores, en primer lugar, la acidez (pH = 3 - 4) del medio de cultivo, generalmente, Desmodesmus sp. crecen en un óptimo de pH = 7, a pesar de que las algas estuvieron protegidas del medio externo, sin embargo, la matriz de alginato es lo suficientemente porosa para permitir la entrada de H+ por difusión simple afectando significativamente a la fisiología de las algas. En segundo, la coloración obscura del té negro impide la incidencia de fotones al interior de las esferas. Los resultados fueron favorables, ya que las microalgas lograron permanecer vivas, siendo muy parecidas las imágenes observadas de las esferas en etapa inicial y las esferas al final del cultivo (Figura 1 d).
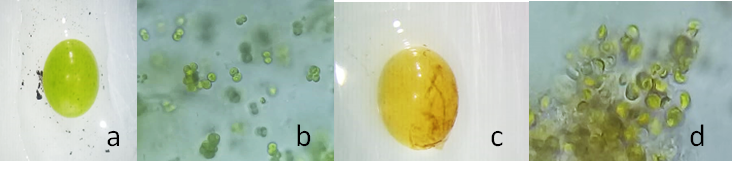
Figura 1. Algas inmovilizadas en esferas observadas en microscopio estereoscópico y corte transversal con aumento x40 en microscopio óptico. a) esfera al inicio de la experimentación; b) corte transversal al inicio x40; c) esfera al final del experimento y d) corte transversal al final del experimento x40
La obtención de CB con esferas inmovilizadas no resultó favorable porque el peso en grosor fue menor al del cultivo C (Fig. 5), lo cual se puede deber a varios factores: 1) el té negro obstruía el paso de los fotones de luz a las algas 2) el té no contaba con los nutrientes necesarios para el crecimiento de las microalgas 3) el pH pudo fue el óptimo para el cultivo de microalgas, 6) el tamaño de las esferas pudo no ser el óptimo.

Figura 2. -a) CB obtenida al finalizar la experimentación. De izquierda a derecha se representan: C3, SA 3, SAAV 1, SAV 3. B) Muestras deshidratadas obtenidas al finalizar la experimentación. De izquierda a derecha se representan: C3, SA 3, SAAV 1, SAV 3
La producción de CB en el medio SAAV comprueba que el agregar algas y aloe vera al medio de cultivo favorece a la misma. Se obtuvieron valores estables en su producción, con la ventaja de encontrarse funcionalizada al mismo tiempo.
Las microalgas sufrieron un daño parcial en la estructura de sus paredes celulares, por lo que el medio de cultivo deberá ser modificado para proporcionar apoyo tanto a las bacterias como a las algas. Para esto se sugiere cambiar el té empleado por uno más claro para permitir el paso de los fotonones a las algas, subir el nivel del pH o encontrar una especie con una mayor resistencia al medio ácido, reemplazar el uso de las esferas por una figura con mayor superficie de contacto y agregar nutrientes para el alga en el medio.