
Actas del Congreso Nacional de
Tecnología Aplicada a Ciencias
de la Salud



Actas del Congreso Nacional de Tecnología Aplicada a Ciencias de la Salud Vol. 4, 2022
En el presente trabajo científico, se plantea el uso de un modelo matemático para poder realizar el diseño de la micro-estructura porosa de un hueso trabecular humano. El diseño computacional es obtenido a partir de las soluciones numéricas de dicho modelo matemático. La simulación computacional de la fase trabecular ósea, proporciona un modelo computacional de la micro-estructura trabecular ósea, para después aplicar el método de elemento finito y obtener datos numéricos que permitan analizar el comportamiento y las propiedades mecánicas que presenta la fase simulada. Así será posible comparar los resultados obtenidos de dos materiales utilizados en la simulación computacional: policaprolactona (PCL) y hueso trabecular humano. Esto permite verificar si el material propuesto para la obtención del andamio por impresión 3D es o no viable.
Palabras Clave: Remodelación Ósea, Giroide, Manufactura Aditiva
In the present scientific work, the use of a mathematical model is proposed to be able to carry out the design of the porous micro-structure of a human trabecular bone. The computational design is obtained from the numerical solutions of said mathematical model. The computational simulation of the bone trabecular phase provides a computational model of the bone trabecular microstructure, to then apply the finite element method and obtain numerical data that allow analyzing the behavior and mechanical properties of the simulated phase. This will make it possible to compare the results obtained from two materials used in the computational simulation: polycaprolactone (PCL) and human trabecular bone. This allows us to verify if the material proposed for obtaining the scaffold by 3D printing is viable or not.
Key Words: Bone Remodeling, Gyroid, Additive Manufacturing
En los últimos años, las investigaciones en ingeniería de tejidos y biomateriales se han orientado a la fabricación de soluciones que estimulen mecanismos naturales del cuerpo humano para la regeneración de los diferentes tejidos, lo cual pertenece a la ciencia de materiales. Este paradigma propone asistir al propio cuerpo en el proceso de reconstrucción del tejido dañado, evitando la exposición a componentes extraños. Además, la mecánica y la ciencia de materiales estudian los efectos y la relación entre las fuerzas aplicadas sobre una estructura o cuerpo rígido y la deformación producida a materiales mixtos como el hueso, por ejemplo. El hueso es [10, 11] un tipo de tejido óseo conectivo, rígido en el exterior (hueso cortical) y poroso de color blanquecino en su interior (hueso trabecular), el cual sirve como soporte del organismo y protección de órganos (función mecánica) que actúa como la parte pasiva del aparato locomotor y también como control del metabolismo de Ca, P y Mg (función fisiológica). El tejido óseo está constituido por la matriz extracelular y células óseas. La matriz extracelular tiene una porción orgánica del 35 % (formada de colágeno y en menor proporción de otras proteínas) y otra porción inorgánica del 65 %, la cual está formada por agua, iones y depósitos de hidroxiapatita (HA). La HA es un material inorgánico y cristalino, compuesto mayoritariamente de calcio, fosfato y carbonato, y minoritariamente hay presencia de fluoruros, magnesio, potasio y sodio. Al colágeno se le atribuyen las propiedades de viscoelasticidad y resistencia, mientras que a la fase mineral se le atribuye la característica de rigidez. La complejidad mecánica del tejido óseo, compuesto de hueso cortical y hueso trabecular, ambos con comportamientos mecánicos distintos, supera la de la mayoría de los materiales utilizados en ingeniería [1]. Más aún, el hueso compacto o cortical es formado por laminillas óseas, que son porciones de matriz ósea inmediatamente aplicadas unas contra otras sin cavidades intermedias, las cuales se disponen de manera radial alrededor de los vasos sanguíneos. A cada conjunto de laminillas se lo denomina osteona. Luego, hay lagunas que están ocupadas por osteocitos que se encuentran interconectadas por canales diminutos, esenciales para la nutrición e intercomunicación de las células óseas. Por su parte, el tejido esponjoso o trabecular es formado por trabéculas, que son laminillas dispuestas en diferentes orientaciones que entran en contacto en algunos puntos, por lo que forman una matriz porosa entre la cual se acumula médula ósea. Los osteocitos se asocian en lagunas intercomunicadas irregularmente y no son penetrados por vasos sanguíneos, sino que están rodeados por los espacios medulares que están vascularizados [10, 11].
Varios experimentos revelan que los factores mecánicos influyen directamente en el remodelado de la fase trabecular a varias escalas, desde el hueso entero, hasta las células óseas. La computación mecánica ha identificado una relación cuantitativa entre estos factores mecánicos y biológicos, incluyendo la remodelación. Estudios recientes sugieren que, considerando la adaptación de una estructura trabecular, la transducción y detección de mecanismos mecánicos que son estimulados a nivel microscópico puede asociarse a la adaptación de la estructura trabecular macromolecular [2]. Por ejemplo: la presencia de poros distribuidos jerárquicamente, genera canales interconectados de 90 a 150 µm de diámetro, necesarios para intercambio de nutrientes y desechos, y canales de 300 a 800 µm de diámetro, necesarios para dar lugar a vascularización. Diámetros de 100 µm equivalen a áreas transversales de 0.01 mm2 y diámetros de 500 µm equivalen a áreas transversales de 0.25 mm2. Adaptar la estructura trabecular a un ambiente mecánico puede atribuírsele a la formación de hueso y el proceso de resorción llamado remodelado. Este proceso celular está ligado al mecanismo de la adaptación estructural tridimensional del hueso entero. Además, el hueso es un compuesto principalmente de colágeno e hidroxiapatita, el cual se encuentra en un proceso de remodelación constante, que incluye una etapa de formación y otra de resorción [3]. La adaptación de estructuras trabeculares en ambientes mecánicos ocurre a una escala muy severa y el fenómeno de adaptación consiste en diferentes mecanismos de acuerdo con la escala utilizada.
Por otro lado, históricamente con el objetivo de facilitar la recuperación del tejido óseo dañado, se han utilizado prótesis metálicas o injertos óseos tanto del propio paciente, como de terceros [4-6], que tienden a generar rechazos o reacciones adversas, en algunos casos, causando mayores inconvenientes que el problema original. La impresión 3D por manufactura aditiva (MA) o manufactura por deposición fundida (MDF), es un proceso que permite crear objetos tridimensionales sólidos a partir de un modelo digital utilizando procesos aditivos con aporte de material de modo que el objeto va creándose mediante capas sucesivas del material a utilizar. Es un conjunto de tecnologías para la reproducción física capa a capa de prototipos y piezas personalizadas mediante softwares especializados, esta técnica puede ser utilizada para la fabricación de andamios de biomateriales usados en la ingeniería de tejidos. Sus aplicaciones en el ámbito médico pasaron de ser una promesa a ser el eje central de numerosas investigaciones y desarrollos [7-9].
El modelado computacional es el uso de computadoras para simular y estudiar sistemas complejos utilizando las matemáticas, las leyes de la física, la química, la biología y/o la informática. Un modelo computacional contiene numerosas variables que caracterizan el sistema bajo estudio. La simulación se realiza ajustando las variables, solas o combinadas, y observando los resultados. Los modelos de hueso trabecular han sido utilizados para estudiar una gran variedad de intervenciones biomecánicas [2, 8, 12, 13]. La simulación de la dinámica células osteogénicas es un modelo prometedor que describe morfologías y el comportamiento de la matriz extracelular [8], mientras que la simulación de la evolución temporal del flujo microscópico de fases de copolímeros dibloque, genera una estructura giroide, la cual está dada por la ecuación de Cahn-Hilliard [15]. Esta ecuación de la física matemática describe el proceso de separación de fases, por el cual los dos componentes de un fluido binario se separan espontáneamente y forman dominios porosos en cada componente.
En este trabajo científico se propone una nueva metodología de obtención de materiales poliméricos con porosidad controlada, utilizando la ecuación de Chan-Hilliard con un término de advección y la técnica de impresión 3D por manufactura de deposición fundida.
Se propone estudiar y analizar las propiedades mecánicas de un andamio polimérico compuesto por Policaprolactona (PCL) y Nano Hidroxiapatita (NHA utilizando el método de Elemento Finito en el software de diseño “Free Cad”, por lo cual se propone la siguiente metodología:
Preparación del biomaterial: Se utiliza policaprolactona (PCL) y nano hidroxiapatita (NHAP), además de utilizar agua para preparar las soluciones, se utilizan 3 ml de agua para cada solución, la PCL se utiliza al 9%, mientras que la hidroxiapatita al 3 o 5%, cada solución se prepara durante 3h a 40°C y con agitación de 800 RPM. Luego las soluciones se transfieren a una matriz polimérica de la fase inversa de la solución numérica obtenida de la ecuación de Cahn-Hilliard advectiva, la cual es obtenida mediante una impresora 3D por deposición fundida.
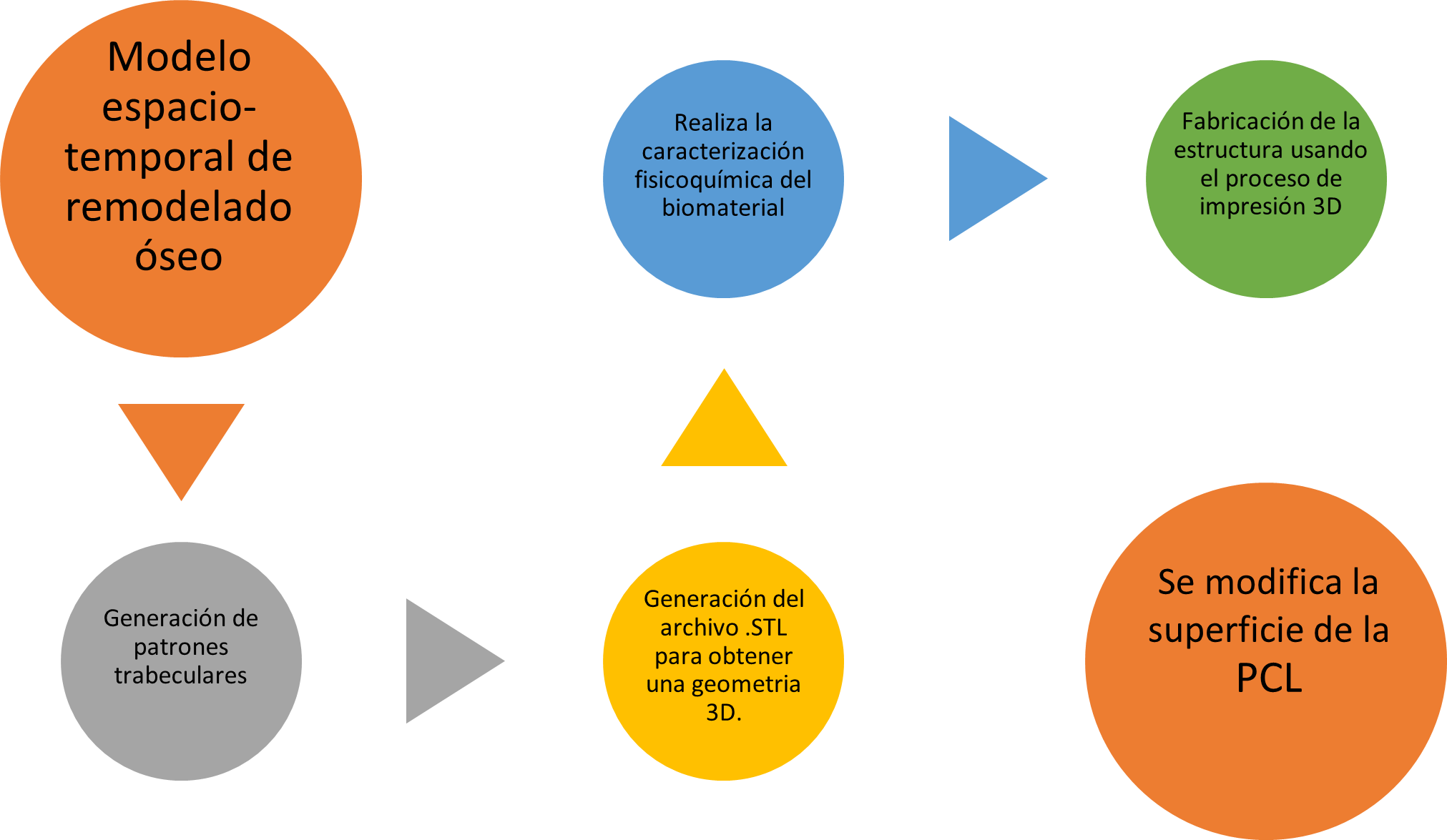
Figura 1. Diagrama del proceso para diseñar un andamio 3D y su obtención por MDF
Diagrama del proceso para diseñar un andamio3D y su obtención por MDF
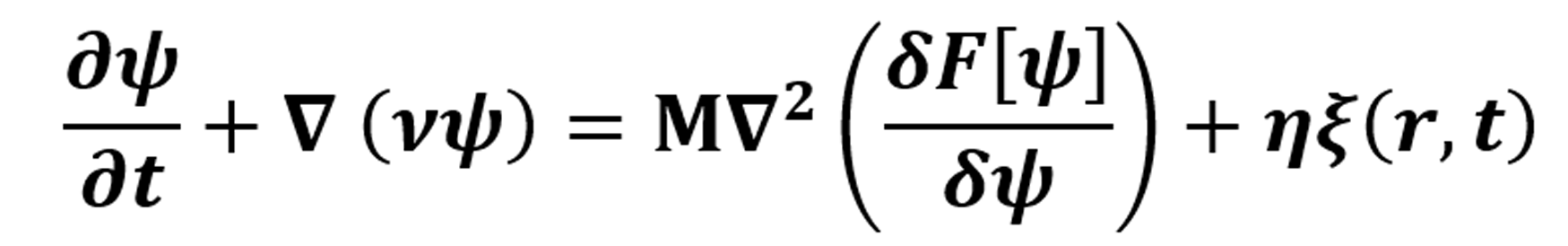
donde 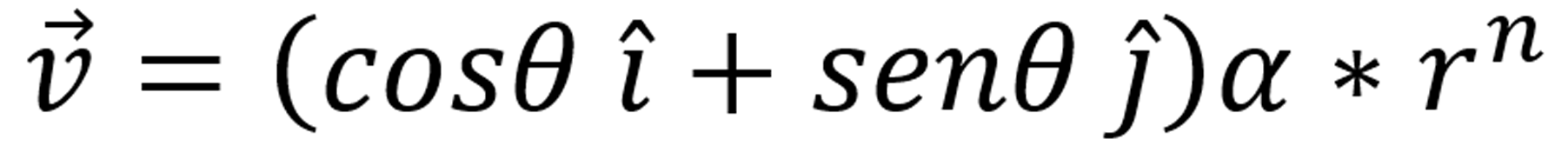 con n = 1, -1, V= (Vx, Vy, Vz) son el flujo, M es el fenómeno de movilidad constante.
con n = 1, -1, V= (Vx, Vy, Vz) son el flujo, M es el fenómeno de movilidad constante.
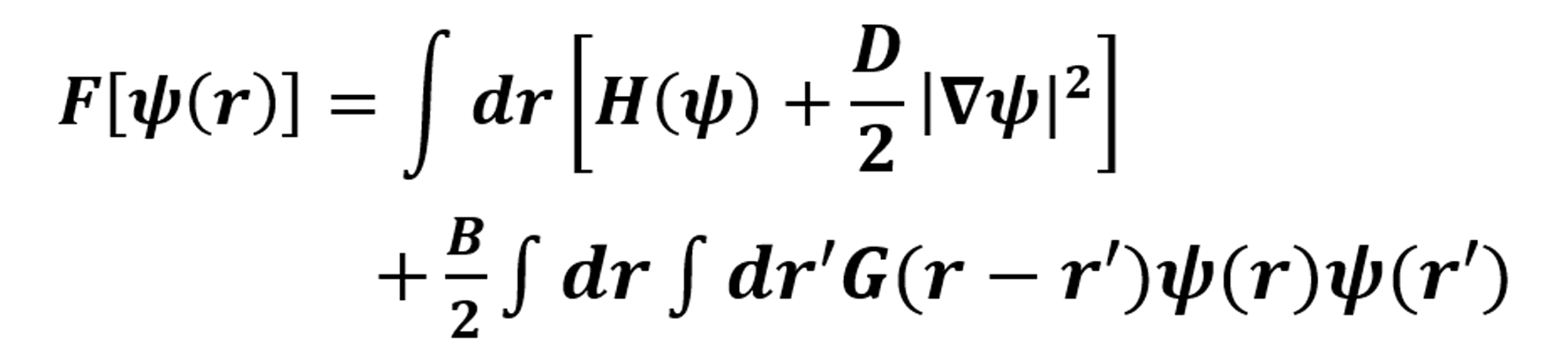
donde F es el funcional de la Energía Libre. Luego de esto, se resuelve utilizando un método numérico por diferencia funcional y Euler modificado implementado en código bajo Python, intercambiando los parámetros de la ecuación hasta que nos dé una fase 2D similar a una microestructura ósea [14], la cual muestra las trabéculas del hueso más definidas, para así realizar un código similar, pero para una fase 3D que genera un archivo en formato pkl. Este archivo se graficó en el visualizador mayavi, en el cual pudimos ver la presencia de poros interconectados o una estructura giroide asimétrica. Una vez realizado dicho procedimiento, el archivo obj (obtenido de mayavi), fue renderizado con meshmixer para poder convertir el archivo con formato obj, a un archivo que puede reconocer el software de diseño en formato stl. Ahí mismo, en el meshmixer se realizó una purificación del diseño, en la cual se le corrigieron algunos defectos que mostraba la pieza cuando se intentaba realizar la simulación por elemento finito. Por consiguiente, se realizaron los pasos correspondientes para aplicar Elemento Finito a nuestro objeto: La fuerza es un vector con magnitud, dirección y punto de aplicación, que cuando se actúa sobre un cuerpo cambia la velocidad o la forma de este. Se mide en newtons y se presenta en varias formas. La carga y el desplazamiento pueden normalizarse como esfuerzo y deformación respectivamente utilizando las dimensiones del objeto. Se realizó la simulación para determinar la tensión máxima y la deformación máxima de nuestra estructura. Finalmente, el diseño se envía a imprimir con una impresora 3D de polímeros por manufactura aditiva (ver Fig. 1).
El aspecto mecánico del hueso trabecular humano es completamente 3D debido a las trabéculas, las cargas externas aplicadas de igual manera son 3D, el FEM con alta resolución es muy usado en simular cambios de remodelación superficial en conjunto con una estructura trabecular 3D. Se observó una estructura giroide asimétrica bicontinua, si la simulación se corre a más de 300,000 pasos, los efectos de la forma trabecular desaparecerán (ver Fig. 2).
Para observar el comportamiento del hueso trabecular ante una fuerza de tensión, se realizaron 6 pruebas experimentales de simulación, variando la carga de 100 a 800 N en intervalos de 100, pero además se varió el material que presentaba la estructura.
El color en las simulaciones indica la equivalencia del valor de estrés en la parte del hueso, demostrando que una condición de carga externa determina la tensión mecánica de las trabéculas individuales. La orientación trabecular depende de la dirección de la carga aplicada en las superficies (ver Fig. 3).
Con este tipo de análisis podemos deducir que zonas del hueso o implante no se producirán remodelaciones significativas a causa de la aplicación de una carga determinada. La estructura trabecular reproducida en la simulación computacional es una estructura funcional para ser aplicada como andamio poroso con capacidad regenerativa. Gracias a esta simulación podemos cuantificar y entender la adaptación mecánica que tiene una estructura trabecular en el proceso de regeneración ósea.
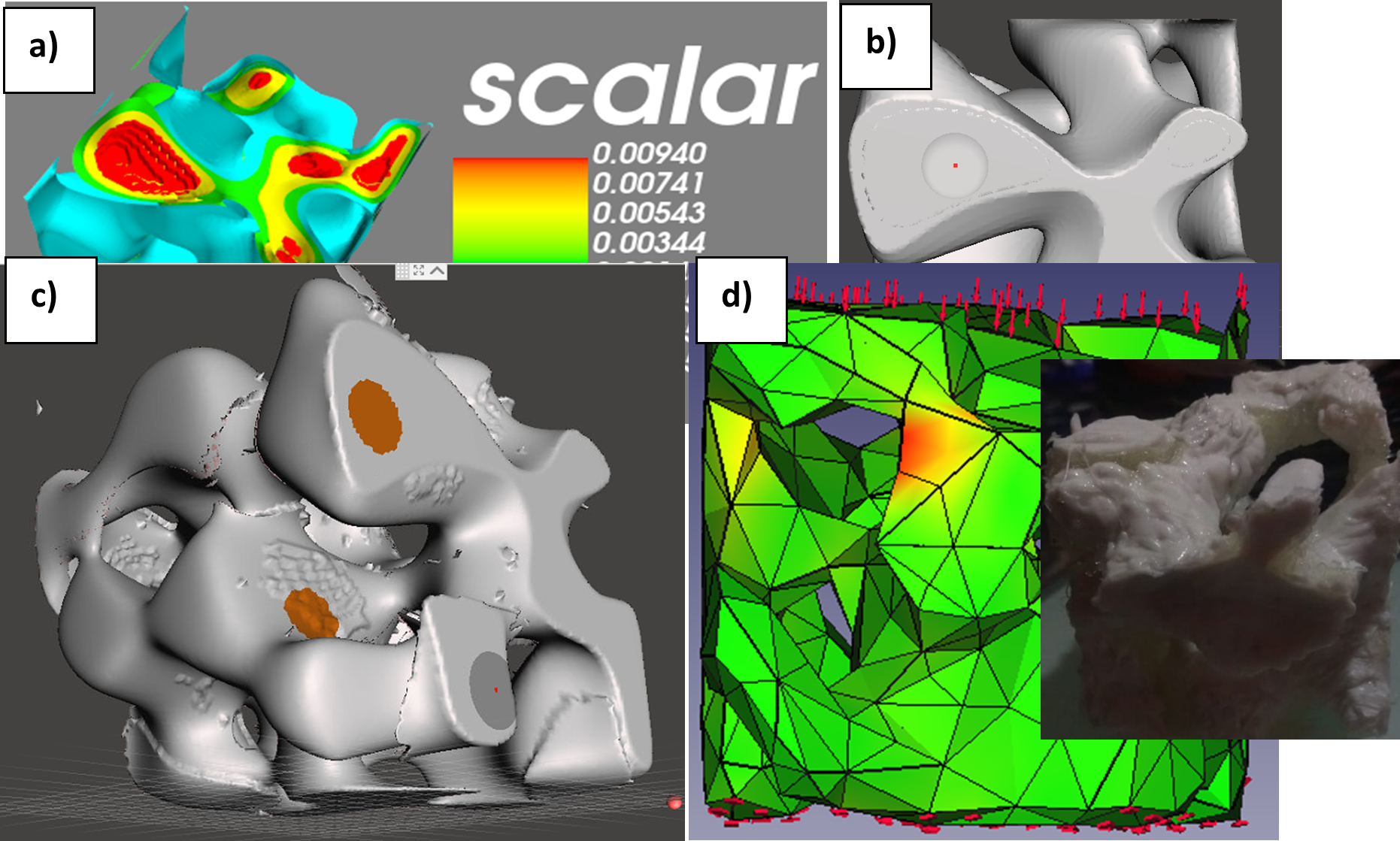
Figura 2. a) Aquí se muestra el análisis realizado en mayavi, donde podemos observar la forma trabecular que tiene el hueso, así como también podemos observar que la fase amarilla son tubos que se conectan a la superficie. b) Interfaz de meshmixer. c) En meshmixer se detalló la pieza eliminando todas esas imperfecciones hasta dejarla lo más lisa y sólida posible. d) Para una primera prueba de elemento finito para determinar las tensiones y deformaciones, se realizaron las corridas para las 6 superficies, aplicando carga desde los 100 hasta los 800 newtons en cada una. La imagen del recuadro en d), muestra el patrón 3D obtenido por impresión 3D inversa
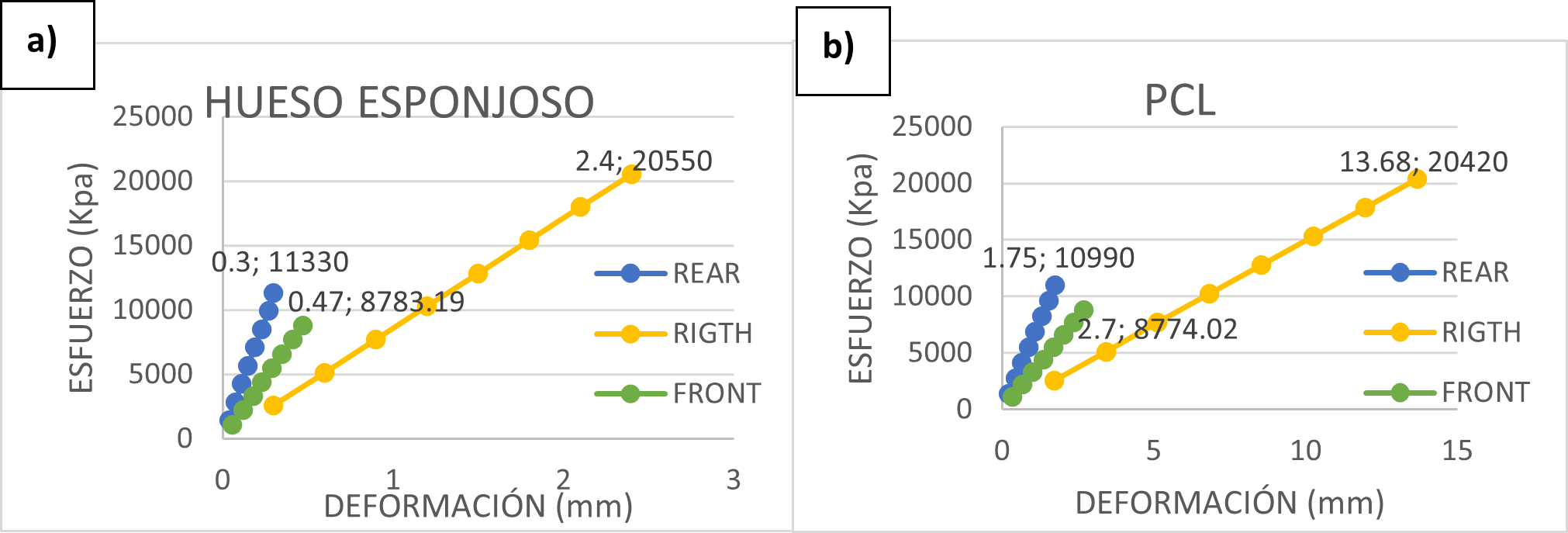
Figura 3. Gráfica Esfuerzo vs Deformación: a) fase trabecular de Hueso esponjoso. b) andamio polimérico compuesto de Policaprolactona
El modelado computacional permite a los científicos realizar miles de experimentos simulados por computadora. Los miles de experimentos por computadora identifican los pocos experimentos de laboratorio que tienen más probabilidades de resolver el problema bajo estudio.
Los modelos computacionales de hoy en día pueden estudiar un sistema biológico en múltiples niveles. Los modelos de cómo se desarrolla una enfermedad incluyen procesos moleculares, interacciones intercelulares, y cómo dichos cambios afectan los tejidos y los órganos.
El comportamiento biomecánico del hueso resulta extremadamente complejo debido a su carácter heterogéneo, anisotrópico y viscoelástico. Debido al carácter anisotrópico del hueso, sus propiedades biomecánicas varían en función de la dirección en la cual se aplica la fuerza. Así, el hueso mostrará una resistencia distinta según se apliquen fuerzas de compresión, tracción o corte.
Los ensayos de compresión se emplean a menudo para muestras de hueso trabecular o cortical, o para cuerpos vertebrales. Los huesos largos como fémur o tibia suelen someterse a ensayos de tracción, torsión o flexión. En estos últimos, se produce una combinación de fuerzas de compresión en la cara en la que se aplica la fuerza, y de fuerzas de tracción en la cara opuesta.
La relación entre las propiedades estructurales, las propiedades materiales y el comportamiento mecánico del hueso es complicada y supone todo un desafío. La comprensión de esta relación es de gran importancia ya que ayuda a entender el comportamiento del hueso sometido a constantes cargas fisiológicas, identifica las áreas más susceptibles a la fractura y permite predecir los efectos de distintas patologías y de los tratamientos de las mismas en la resistencia del hueso.
Las características básicas de la estructura final obtenida son similares a las obtenidas en el estudio 2D que se realizó en un principio. Este trabajo de investigación describe un método para generar de igual manera un andamio de PCL/HA que es económicamente eficiente con un alto potencial de uso en regeneración ósea. El material que se generó se obtuvo a partir de la imitación de la estructura trabecular para simular el hueso.