
Actas del Congreso Nacional de
Tecnología Aplicada a Ciencias
de la Salud



Actas del Congreso Nacional de Tecnología Aplicada a Ciencias de la Salud Vol. 5, 2023
El Instituto Mexicano del Seguro Social (IMSS) y el Instituto Nacional de Estadística Geografía (INEGI), reportaron en el 2023 que en México se registran cada año un aproximado de 14,000 muertos a causa de enfermedades renales.
En este proyecto, utilizando espectroscopia Raman, se realiza un análisis comparativo de la caracterización de muestras de suero sanguíneo de tres donadores sanos y nueve pacientes con avances distintos de enfermedades renales, con el propósito de identificar biomarcadores. En el análisis de resultados se visualizan las diferencias y similitudes de los espectros, obteniendo la información sobre las diferentes concentraciones de los compuestos causantes de las principales enfermedades renales, demostrando que la espectroscopia Raman puede ser un método diagnóstico de estas patologías.
Palabras claves: Suero sanguíneo, espectroscopia Raman, diagnóstico
The Mexican Institute of Social Security (IMSS) and the National Institute of Geographic Statistics (INEGI) reported in 2023 that in Mexico approximately 14,000 deaths are registered each year due to kidney diseases.
In this project, using Raman spectroscopy, a comparative analysis of the characterization of blood serum samples from three healthy donors and nine patients with different advances of renal diseases is performed in order to identify biomarkers. In the analysis of the results, the differences and similarities of the spectra are visualized, obtaining information about the different concentrations of the compounds causing the main renal diseases, demonstrating that Raman spectroscopy can be a diagnostic method for these pathologies.
Key words: Blood serum, Raman spectroscopy, diagnostic
Las enfermedades o afecciones renales son la incapacidad progresiva e irreversible del riñón para mantener sus funciones normales, siendo estas unas de las causas más frecuentes de mortalidad en México y en el mundo. Se trata de trastornos considerados una enfermedad catastrófica, término que la salud pública otorga a los padecimientos que presentan un incremento en el número de casos, altos costos de inversión, recursos humanos, materiales limitados por la detección y referencia tardía [1].
La espectroscopia Raman es una técnica empleada para el análisis cuantitativo de prácticamente cualquier material ya sea orgánico o inorgánico, proporciona en pocos segundos información química y estructural del compuesto estudiado, permitiendo así, su identificación. La espectroscopia Raman se fundamenta en la interacción con un haz de luz monocromática, en la cual, una pequeña parte de la luz se dispersa de manera inelástica, resultando en sutiles modificaciones de la frecuencia que son distintivas para el material en cuestión. Posteriormente, la frecuencia registrada se representa gráficamente y se utiliza para identificar los grupos funcionales predominantes, junto con la evaluación de su intensidad espectral [2].
El objetivo de este estudio es caracterizar y comparar el suero sanguíneo de tres donadores sanos y nueve pacientes con enfermedades renales en estadios diferentes de la enfermedad. Se utiliza la espectroscopia Raman para determinar los posibles biomarcadores característicos y obtener información sobre la presencia, ausencia y concentración de diferentes moléculas y compuestos, como aminoácidos, proteínas, lípidos y carbohidratos.
La espectroscopia se originó como el estudio de la interacción entre radiación y materia en función de la longitud de onda. Actualmente la espectroscopia comprende el uso de los efectos de absorción, emisión o dispersión de radiación electromagnética por la materia con el objetivo de estudiar cualitativa o cuantitativamente la materia. La espectroscopia Raman es una técnica poderosa que se utiliza para analizar los grupos funcionales activos presentes en el suero sanguíneo, es una técnica espectroscópica utilizada en química y física de la materia condensada para estudiar los modos de baja frecuencia en un sistema. Se basa en la dispersión inelástica de luz monocromática, generalmente de un láser, que interactúa con excitaciones en el sistema [3]. La espectroscopia Raman es una técnica no invasiva y prometedora que se utiliza para el análisis de muestras biológicas, como el suero sanguíneo.
El suero sanguíneo es la fracción líquida de la sangre obtenida después de la coagulación. Contiene una amplia gama de compuestos químicos, incluyendo proteínas, lípidos, carbohidratos, metabolitos y electrólitos. Estos componentes desempeñan funciones vitales en el organismo, como el transporte de nutrientes, la eliminación de desechos y la regulación del equilibrio ácido-base. [4].
Al aplicar la espectroscopia Raman al suero sanguíneo, es posible identificar y cuantificar biomarcadores y cambios metabólicos asociados con enfermedades renales. Por ejemplo, se ha demostrado que la concentración de ácido siálico en el suero sanguíneo puede variar en grupos control, pacientes con gingivitis y pacientes que padecen periodontitis [5]. Además, la espectroscopia Raman amplificada de superficie (SERS) puede ser utilizada para caracterizar y obtener información sobre los grupos funcionales activos en el suero sanguíneo para detectar enfermedades renales [6].
Las enfermedades renales son un problema de salud significativo en México. Según datos recientes, la enfermedad renal crónica (ERC) afecta a una proporción considerable de la población mexicana. Factores como la diabetes, la hipertensión y la obesidad contribuyen al aumento de los casos de enfermedad renal en el país. Además, la falta de acceso a servicios médicos adecuados y la falta de conciencia sobre la importancia de la detección temprana agravan aún más la situación. [7]
En el contexto de las enfermedades renales, la espectroscopia Raman ha demostrado su capacidad para detectar alteraciones bioquímicas asociadas con estas enfermedades. Los estudios han revelado cambios en la concentración y distribución de compuestos como proteínas, lípidos y metabolitos en el suero sanguíneo de pacientes con enfermedad renal. [8]
Los problemas renales en México, particularmente la enfermedad renal crónica y la diabetes tipo 2, representan una carga significativa para el sistema de salud [9]. La espectroscopia Raman puede identificar cambios bioquímicos sutiles en el suero sanguíneo que pueden indicar la presencia de enfermedad renal en etapas tempranas, lo que permite una intervención temprana y un mejor manejo de la enfermedad y puede proporcionar información en tiempo real sobre la progresión de la enfermedad renal, lo que ayuda a los médicos a evaluar la eficacia de los tratamientos y ajustarlos según sea necesario.
En un estudio realizado por Staritzbichler y cols, se evaluó la aplicación potencial de la espectroscopia Raman en laboratorios médicos para una variedad de biomarcadores. El estudio analizó espectros Raman de muestras de suero sanguíneo de pacientes con enfermedad hepática utilizando algoritmos matemáticos y validó los resultados en muestras independientes. Se encontró que la espectroscopia Raman tiene un alto potencial para cuantificar múltiples biomarcadores en diagnósticos de laboratorio médico. La prevención del sobreajuste y la validación de datos independientes son importantes en los estudios de espectroscopia Raman [10]. Otro estudio utilizó la espectroscopia Raman para analizar muestras de orina y se identificaron genes clave expresados diferencialmente en la enfermedad renal crónica [11].
Para la parte experimental se empleó un análisis comparativo, metodología que implica elaborar la comparación sistemática de diferentes muestras o grupos con el fin de identificar similitudes y diferencias en las variables de interés. En este caso, se realizó una comparación entre los diferentes ejemplares de suero sanguíneo mostrados en la Figura 1. La obtención de muestras utilizadas, tanto de pacientes sanos como de aquellos que padecen enfermedades, fueron obtenidas en colaboración con un profesional con experiencia en el campo correspondiente y con el previo consentimiento informado de los pacientes involucrados. Las muestras fueron adquiridas exclusivamente con el propósito de servir como material de investigación en el contexto de este estudio.

Figura 1. Muestras de suero sanguíneo
Para la preparación de muestras, con una pipeta se depositó cada suero sanguíneo en cubetas para espectrofotometría. En la realización de las mediciones se utilizó un espectrómetro Raman marca Occean Optics modelo QE65000 con una potencia de 499 mW y una luz láser de 785 nm, el espectrómetro empleado se puede visualizar en la Figura 2. El procesamiento de datos se desarrolló mediante el software Origin 2018.

Figura 2. Espectrómetro Raman
3.1 Resultados
Los resultados se compararon visualmente a través de tres gráficas distintas mostradas en la Figura 3. En la primera gráfica, se agruparon los espectros obtenidos a partir del suero sanguíneo de donadores sanos. En la segunda gráfica, se presentaron los datos de los pacientes que padecen alguna enfermedad renal. La tercera gráfica, permitió la comparación de un espectro de un donador sano con el de un paciente que presenta deficiencia renal.
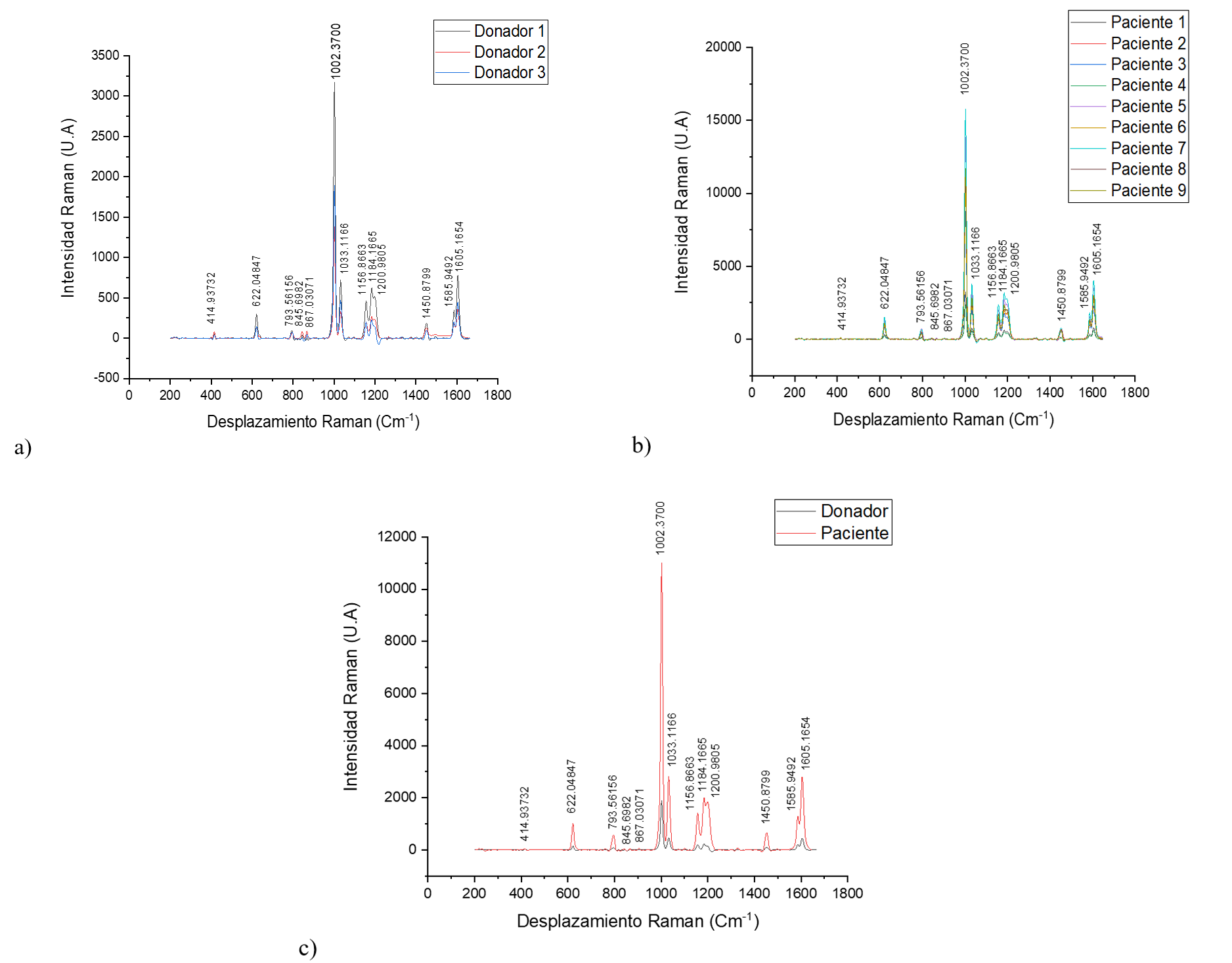
Figura 3. a) Espectros de donadores sanos, b) Espectros de pacientes con enfermedades renales, c) Comparación del espectro de un donador sano con un paciente con afección renal
Al examinar las gráficas, se observó que todos los espectros mostraron picos en rangos de frecuencia similares. Sin embargo, la diferencia notable se encontró en la intensidad de estas frecuencias. La intensidad refleja la cantidad de un compuesto específico presente en la muestra analizada. A través de esta comparación, se pudo apreciar que la intensidad de todos los picos en los espectros de los pacientes con enfermedad renal difiere significativamente de la de los donadores sanos.
Cada pico en el espectro corresponde a la presencia de un grupo funcional particular en una molécula, el procesamiento de datos y la caracterización se visualizan en la Tabla 1. Los grupos funcionales son conjuntos de átomos unidos químicamente que tienen características y propiedades específicas. Estos grupos funcionales agrupan diferentes compuestos químicos que comparten enlaces químicos similares.
Al identificar los picos y asignarlos a grupos funcionales conocidos, podemos inferir la presencia de compuestos químicos que contienen esos grupos funcionales en la muestra analizada. Por ejemplo, si encontramos un pico característico de un grupo funcional de Amidas, podemos deducir que hay compuestos químicos en la muestra que contienen enlaces de tipo peptídicos.
Tala 1: Caracterización de frecuencias Raman para determinar grupos funcionales activos
| Frecuencia Raman (cm-1) | Rango de Frecuencia | Nombre del grupo | Grupo Funcional Raman | Compuestos Químicos |
|---|---|---|---|---|
| 414.93732 | 400-600 | Proteínas | Amidas | Albúmina, Globulinas, Fibrinógeno, Enzimas, Anticuerpos, Creatinina, Urea, Alanina, Prolina, Valina, Treonina, Lisina, Glutamina, Glutamato, Leucina, Isoleucina, Serina, Asparagina, Aspartato, Glicina, Fenilalanina, Tirosina, Triptófano, Metionina, Cisteína. |
| 622.04847 | 600-800 | Azúcares | Carbohidratos | Glucosa, Fructosa, Galactosa, Manosa, Xilosa, Ribosa, Arabinosa, Lactosa, Maltosa, Sacarosa. |
| 793.56156 | 750-900 | Proteínas/ Lípidos | Colina/ Fosfolípidos | Prolina, Hidroxiprolina, Glicina, Serina, Alanina, Glutamina y Asparagina, Colina, Fosfatidilcolina, Fosfatidiletanolamina, Fosfatidilinositol, Fosfatidilserina, Esfingomielina. |
| 845.6982 | 800-900 | Proteínas/ Lípidos | Proteínas/ Lípidos | Prolina, Hidroxiprolina, Glicina, Serina, Alanina, Glutamina, Asparagina, Colina,Fosfatidilcolina, Fosfatidiletanolamina, Fosfatidilinositol, Fosfatidilserina, Esfingomielina. |
| 867.03071 | 800-900 | Proteínas/ Lípidos | Proteínas/ Lípidos | Prolina, Hidroxiprolina, Glicina, Serina, Alanina, Glutamina, Asparagina, Colina,Fosfatidilcolina, Fosfatidiletanolamina, Fosfatidilinositol, Fosfatidilserina, Esfingomielina. |
| 1002.3700 | 900-1100 | Lípidos | Ésteres | Prolina, Hidroxiprolina, Glicina, Serina, Alanina, Glutamina, Asparagina, Colina,Fosfatidilcolina, Fosfatidiletanolamina, Fosfatidilinositol, Fosfatidilserina, Esfingomielina. |
| 1033.1166 | 1000-1100 | Proteínas/ Lípidos | Amidas/ Ésteres | Beta-caroteno, Licopeno, Amidas de Ácidos Grasos, Fosfolípidos, Colesterol Esterificado. |
| 1156.8663 | 1100-1200 | Proteínas | Amidas | Glucosa, Colágeno, Elastina, Albumina, Globulinas, Fibrinógeno, Hemoglobina, Mioglobina, Proteínas de fase aguda (CRP, haptoglobina, etc.), Creatinina. |
| 1184.1665 | 1100-1200 | Proteínas | Amidas | Prolina, Hidroxiprolina, Glicina, Serina, Alanina, Glutamina y Asparagina, Fenilalanina, Tirosina, Triptófano, Histidina. |
| 1200.9805 | 1100-1300 | Aminoácidos/ Ácidos Nucleicos | Aminoácidos/ Ácidos Nucleicos | Prolina, Hidroxiprolina, Glicina, Serina, Alanina, Glutamina y Sparagina, Ácidos nucleicos (ADN, ARN). |
| 1450.8799 | 1400-1500 | Proteínas | Amidas | Ácidos Grasos, Triglicéridos, Fosfolípidos, Amidas de Aminoácidos y Urea. |
| 1585.9492 | 1500-1600 | Proteínas | Amidas | Prolina, Hidroxiprolina, Glicina, Serina, Alanina, Glutamina y Asparagina, Amidas de Proteínas (I, II, III, IV, V), Ácido Úrico. |
| 1605.1654 | 1500-1700 | Proteínas | Amidas | Prolina, Hidroxiprolina, Glicina, Serina, Alanina, Glutamina y Asparagina, Amidas de Proteínas (I, II, III, IV, V), Creatinina. |
La metodología utilizada, análisis comparativo, en el procesamiento de los espectros obtenidos mediante espectroscopia Raman de suero sanguíneo aporta información sobre grupos funcionales activos de cada muestra. Los picos presentados en los espectros de donadores sanos y pacientes con enfermedades renales difieren en la intensidad Raman, además se localizaron picos característicos de grupos funcionales, lo que podría mostrar la posibilidad de utilizar la espectroscopia Raman como una herramienta altamente sensible para la detección temprana y diferenciación de enfermedades renales, ya que cada pico representa un grupo funcional distinto que podría servir como indicador de la presencia de alguna deficiencia renal específica. La notable variación en las intensidades de los espectros indica la posible existencia de rangos de intensidad que podrían ser considerados para determinar la salud de una persona, lo que podría tener un impacto significativo en la atención médica y el diagnóstico de estas condiciones.
Sin embargo, es necesario realizar un mayor número de pruebas, así como comparar los resultados con estándares de referencia para respaldar plenamente la hipótesis.