
Actas del Congreso Nacional de
Tecnología Aplicada a Ciencias
de la Salud



Actas del Congreso Nacional de Tecnología Aplicada a Ciencias de la Salud Vol. 6, 2024
Este trabajo representa el primer avance en establecer las bases para evaluar materiales adecuados para producir córneas artificiales en México, con el objetivo de abordar la demanda continua de tejido corneal humano. Se estudia el polidimetilsiloxano (PDMS), reconocido por su versatilidad, durabilidad y rentabilidad en la investigación biomédica, oftálmica y óptica1. Esta evaluación implicó preparar muestras de PDMS con diferentes concentraciones de dos reactivos y someterlas a diferentes temperaturas de curado para evaluar sus propiedades citotóxicas. Utilizando pruebas con Bacillus clausii2, se encontró una ausencia de citotoxicidad en todas las muestras de PDMS, sentando las bases para estudios más detallados sobre la interacción del PDMS con células oculares específicas.
Palabras claves: PDMS, Citotoxicidad, Bacillus clausii, córnea artificial
This work represents the first advancement in establishing the foundation for evaluating materials suitable for producing artificial corneas in Mexico, aiming to address the continuous demand for human corneal tissue. We focused on polydimethylsiloxane (PDMS), which is recognized for its versatility, durability, and cost-effectiveness in biomedical, ophthalmic, and optical research1. The evaluation involved preparing PDMS samples with varying concentrations of two reagents and subjecting them to different curing temperatures to assess their cytotoxic properties. Using Bacillus clausii tests2, we found an absence of cytotoxicity in all PDMS samples, laying the groundwork for further detailed studies on PDMS interaction with specific ocular cells.
Keywords: PDMS, Cytotoxicity, Bacillus clausii, artificial cornea
La ceguera bilateral es una condición que afecta a 43 millones de personas en todo el mundo3, siendo las enfermedades de la córnea las responsables de cerca de 10 millones de éstas3–5. En México, hasta julio de 2024, se han realizado 1724 trasplantes de córnea, mientras que 3071 personas aún están en espera de un donador6.
Los trasplantes de córnea son fundamentales para restaurar la visión en personas con enfermedades corneales graves4; sin embargo, la disponibilidad de donantes sigue siendo limitada. Por esta razón, la investigación y desarrollo de córneas artificiales se han convertido en una necesidad. Entre los materiales que resultan más prometedores para la fabricación de córneas artificiales, se encuentra el polidimetilsiloxano (PDMS), conocido por su transparencia y flexibilidad7.
No obstante, antes de avanzar en la implementación de PDMS en esta aplicación específica, es imprescindible realizar pruebas de citotoxicidad. Estas pruebas son cruciales para garantizar que el material no es tóxico para las células humanas cuando es sometido a procesos de curado diferentes a los recomendados por el fabricante, previniendo así efectos adversos como irritación, rechazo o muerte celular. A pesar de que el fabricante no reporta toxicidad del PDMS en concentración 10:1 curadas a 100, 125 y 150 °C durante 35, 20 y 10 min, respectivamente; para acercarse al índice de refracción de la córnea, es necesario variar los parámetros de concentración y curado del PDMS. En este contexto, la citotoxicidad del PDMS se evalúa como un primer paso esencial en la validación del uso de PDMS en córneas artificiales. En este estudio se evaluó la citotoxicidad del PDMS para tres concentraciones diferentes de base:catalizador, proporcionando datos importantes para su posible uso en la fabricación de queratoprótesis8.
Por lo tanto, el objetivo general de este trabajo es analizar la toxicidad del PDMS mediante pruebas de laboratorio con Bacillus clausii. Los resultados obtenidos permitirán ampliar el rango de parámetros de curado que, según el proveedor, no presentan toxicidad, y avanzar en el estudio del PDMS como posible material para la elaboración de queratoprótesis.
Para alcanzar este objetivo, en la Sección 2 se presentan los conceptos básicos que sustentan el estudio de citotoxicidad. En la Sección 3, se describe el procedimiento experimental llevado a cabo en el laboratorio. La Sección 4 presenta los resultados de las pruebas, los cuales son analizados en la Sección 5. Finalmente, en la Sección 6 se exponen las conclusiones derivadas de este trabajo.
2.1 Pruebas de Citotoxicidad
Las pruebas de citotoxicidad son esenciales en el desarrollo y evaluación de nuevos materiales destinados a aplicaciones biomédicas9–11. Estas pruebas permiten determinar si un material puede causar daño a las células vivas y evaluar su compatibilidad con el entorno biológico.
Las pruebas de citotoxicidad evalúan la toxicidad de un material mediante la exposición de células vivas, como células humanas o bacterias, al material en cuestión. Se mide la viabilidad celular, es decir, la capacidad de las células para sobrevivir y proliferar en presencia del material11.
2.2 Bacillus clausii en Pruebas de Citotoxicidad
Bacillus clausii es una bacteria probiótica conocida por su resistencia a condiciones adversas y su capacidad para promover la salud intestinal2. Además, es capaz de producir enzimas y metabolitos que pueden neutralizar toxinas y promover el equilibrio microbiano en el intestino humano2,12. Esta bacteria grampositiva, formadora de esporas, tiene la capacidad de sobrevivir en ambientes extremos, como altos niveles de pH y presencia de antibióticos13, lo que la hace particularmente útil en estudios de toxicidad.
Las pruebas de citotoxicidad con B. clausii implican la exposición de esta bacteria a materiales como el PDMS y la evaluación de su crecimiento y viabilidad.
2.3 Propiedades del PDMS
El polidimetilsiloxano (PDMS) es un material polimérico ampliamente utilizado en diversas aplicaciones biomédicas e industriales debido a sus propiedades únicas1. Este elastómero se caracteriza por su biocompatibilidad, lo que lo hace adecuado para su uso en dispositivos médicos y aplicaciones en ingeniería de tejidos8. Además, el PDMS es notable por su permeabilidad a los gases, permitiendo el intercambio de oxígeno y dióxido de carbono7,8.
Una de las ventajas más destacadas del PDMS es su transparencia óptica1, lo que facilita su uso en microscopía y en la fabricación de dispositivos ópticos. El PDMS también presenta una alta inercia química y estabilidad térmica14, lo que lo hace resistente a diversas condiciones químicas y térmicas. Estas propiedades, junto con su manipulación y manejo sencillo, hacen del PDMS un material versátil en múltiples aplicaciones.
Además, el PDMS es un material de bajo costo14, lo que lo hace económicamente viable para la producción a gran escala. Esta combinación de propiedades mecánicas, químicas y económicas ha situado al PDMS como un material de elección en numerosas aplicaciones tecnológicas y científicas.
3.1 PDMS
El PDMS (Sylgard 184 de Dow Corning) se preparó mezclando dos componentes: la base (el polímero) y el agente de curado (el catalizador). Para una concentración de 10:1, se utiliza una proporción de 10 partes de la base por 1 parte del agente de curado en peso (Figura 1).
Se pesaron 10 partes de la base de PDMS en un vaso de precipitado y 1 parte del agente de curado y se añadió al recipiente de mezcla. Se mezclaron lentamente con un agitador de vidrio por un minuto para asegurar una mezcla homogénea y minimizar la formación de burbujas.
Posteriormente, se vertió la mezcla de PDMS en un molde de aluminio cuadrado de 8.00 cm de lado y hasta un grosor de 1.5 mm, asegurando hacerlo de manera uniforme para evitar la formación de burbujas. Se dejó reposar la mezcla durante 20 min para desgasificar.
Figura 1. Preparación de PDMS
Para el proceso de curado, se precalentó la mufla Mufla FE-360 durante 4 h a 100°C y posteriormente se introdujo la placa de PDMS durante 28 min; pasado ese tiempo, se retiró del horno con cuidado, se dejó enfriar y se desmoldó usando pinzas pequeñas.
Este proceso se repitió para dos concentraciones más siguiendo los parámetros mostrados en la Tabla 1. Estas proporciones se eligieron para evaluar el efecto del catalizador en el crecimiento bacteriano.
Tabla 1. Parámetros utilizados para las tres concentraciones de PDMS
| Razón de mezcla (base:catalizador) |
Temperatura de curado (°C) |
Tiempo de curado (min) |
|---|---|---|
| 10:1.0 | 100 | 28 |
| 10:1.5 | 170 | 28 |
| 10:2.0 | 230 | 28 |
3.2 Pruebas de Citotoxicidad
En una zona de asepsia generada por mecheros de alcohol y usando materiales estériles, 100 µL de esporas de B. clausii de 2 mil millones de UFC/5 mL se sembraron en placa de Agar Triptona-Soya (TSA). La placa se incubó a 37°C durante 24 horas para permitir el crecimiento adecuado de las bacterias, como se ejemplifica en la Figura 2.
Las colonias de B. clausii se recolectaron utilizando 5 mL de Tampón Fosfato Salino (PBS) estéril. Con las bacterias recolectadas se preparó una solución inicial de B. clausii en medio Caldo Soja Tripticaseína (TSB) en tubos tipo Falcon de 15 mL con una densidad óptica (DO) inicial establecida en 0.300 medida en un lector de absorbancia de microplacas iMark usando un filtro de 595 nm. A partir de esta, se hizo otra concentración a un octavo (1:8) de la inicial. Esta dilución permitió evaluar el crecimiento bacteriano para distintas concentraciones de B. clausii.
A cada una de las dos concentraciones de B. clausii se le añadieron cuatro discos de PDMS de 6 mm de diámetro y un peso promedio de 0.042 g cada uno, que previamente habían sido lavados 4 veces con agua estéril.
Cada muestra, junto con su respectivo control negativo (sin PDMS), se incubó en agitación constante a 37°C y 100 rpm. La agitación se mantuvo para asegurar una mezcla homogénea y la adecuada exposición de las bacterias al medio de cultivo y al PDMS.
Se midió el crecimiento bacteriano cada 24 h utilizando un lector de placas iMark con un filtro de 595 nm. La absorbancia se registró para determinar la DO de las muestras y así monitorear la cinética de crecimiento.
Pasadas 72 horas de incubación, se realizaron diluciones adecuadas de todas las muestras. Las diluciones se sembraron en placas de TSA y se incubaron a 37 °C durante 24 horas. Después de la incubación, se contaron por inspección visual las unidades formadoras de colonias (UFC) en cada placa. Este conteo permitió determinar la viabilidad y el crecimiento de las bacterias en presencia de las diferentes concentraciones de PDMS.
Todos los experimentos se realizaron por triplicado para asegurar la reproducibilidad y la validez estadística de los resultados.
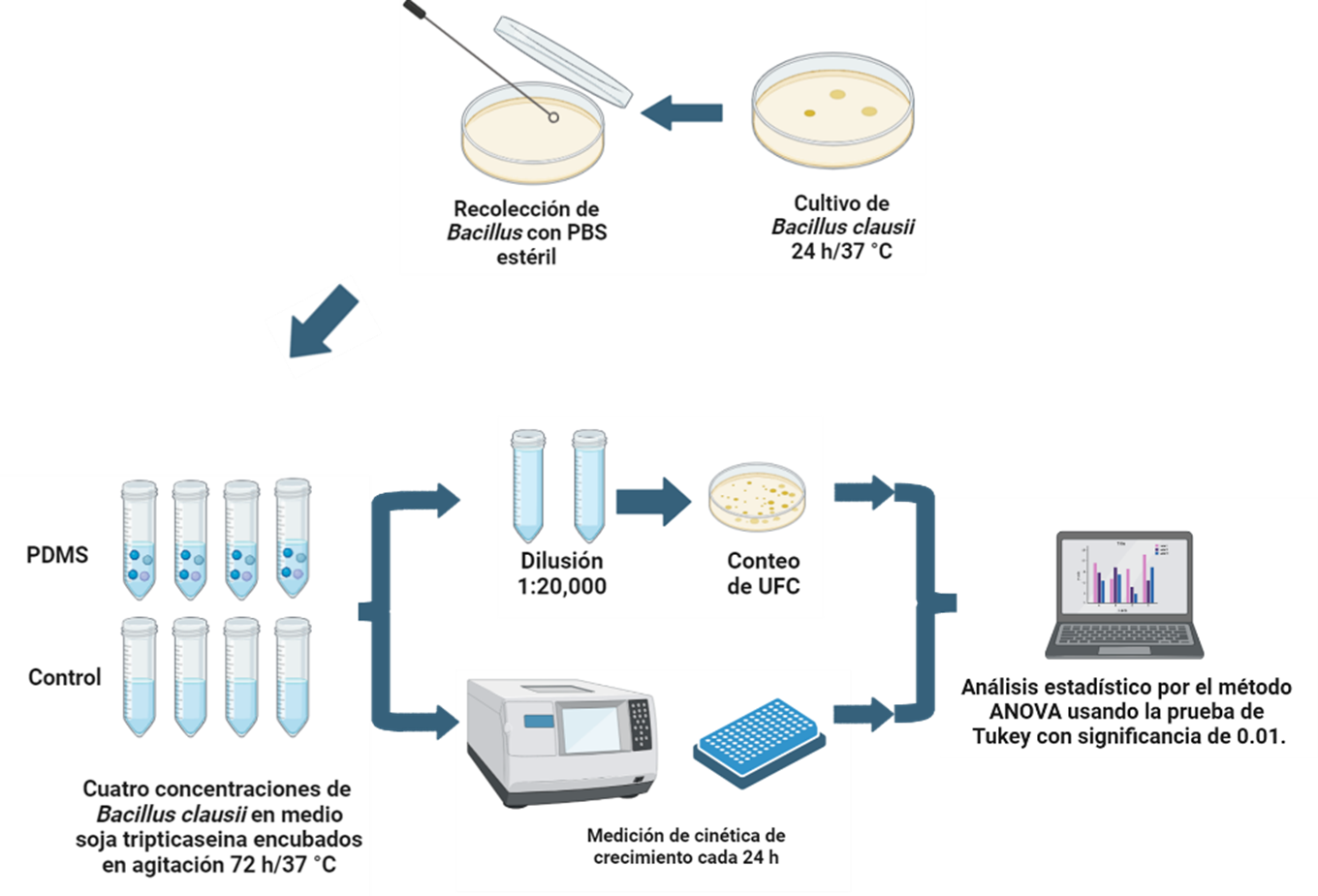
Figura 2. Metodología llevada a cabo para realizar las pruebas de citotoxicidad y viabilidad celular
Los datos recabados se analizaron estadísticamente utilizando el software Origin 2016. Para realizar la prueba de hipótesis, se estableció el valor p (valor de probabilidad) en p < 0.01 mediante ANOVA unidireccional. Para la comparación de datos con respecto al control negativo se realizaron las pruebas de comparación múltiple de Tukey.
4.1 Cinética de Crecimiento
Para evaluar la citotoxicidad del PDMS en B. clausii, se midió la cinética de crecimiento mediante la DO, expresada como porcentaje del valor inicial, se tomó como referencia al 100% a las cero horas. A continuación, se presentan los resultados obtenidos a través de las dos concentraciones de bacterias para las 3 diferentes razones de base:catalizador del PDMS.
La Figura 3a muestra las curvas de crecimiento de B. clausii, comparando los controles negativos (barras más claras) y las muestras con PDMS a razón 10:1, 10:1.5 y 10:2 (barras más oscuras) para la concentración inicial. De manera similar, en la Figura 3b se aprecia el comportamiento descrito anteriormente, pero para una concentración reducida a un octavo de la inicial.
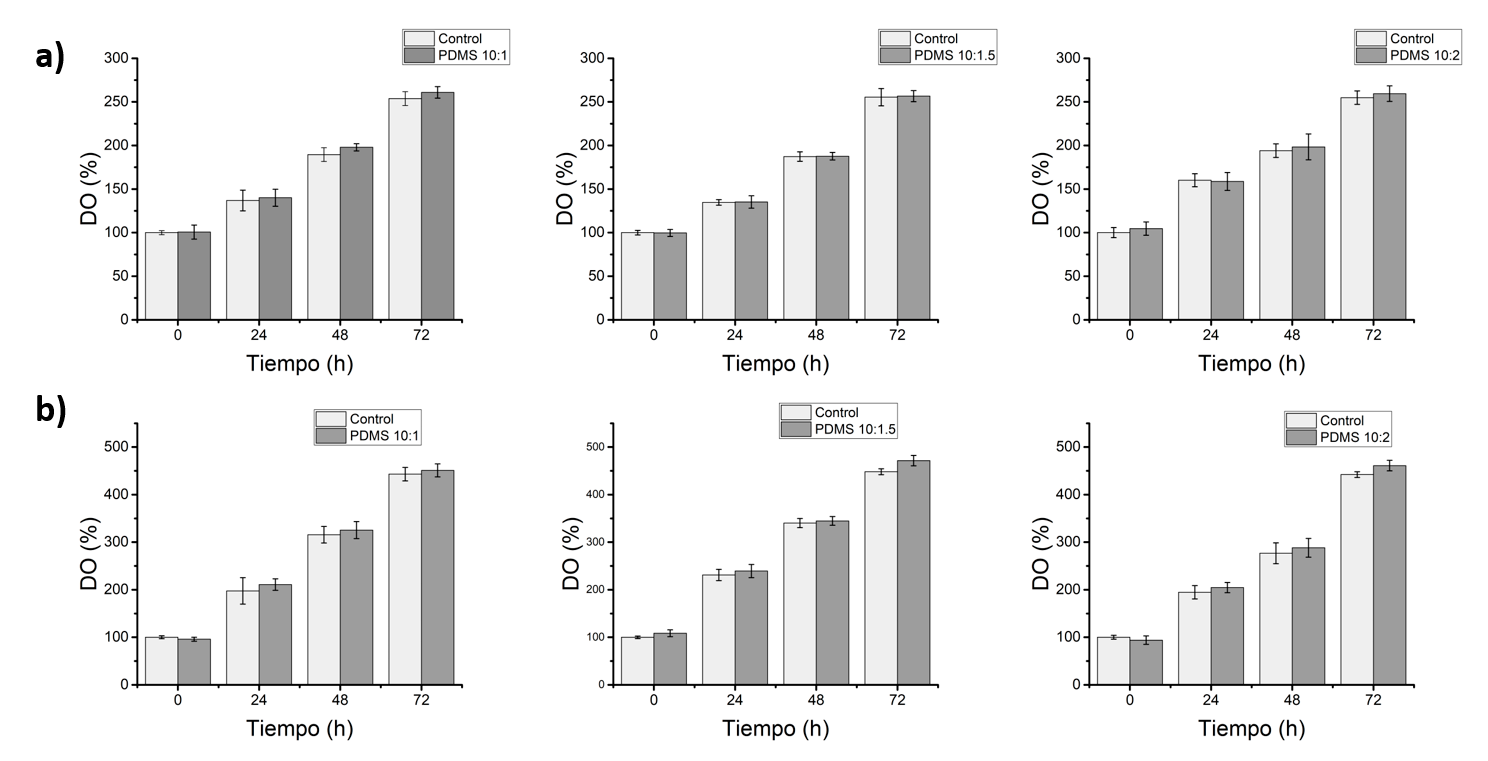
Figura 3. Porcentaje de DO para concentraciones de Bacillus clausii a) concentración 1 y b) concentración 1:8 para tres razones de base catalizador de PDMS
En ambas concentraciones, la DO aumenta gradualmente a lo largo del tiempo, reflejando el crecimiento bacteriano. Aunque las muestras con PDMS tienden a presentar una DO ligeramente mayor que los controles en todos los puntos temporales, estas diferencias no fueron estadísticamente significativas, según la prueba de hipótesis t de Student a un nivel de significancia con p < 0.05.
Del análisis de la concentración más alta de bacterias para del PDMS a razón 10:1, la DO inicial del control negativo y positivo fue de aproximadamente 100%, aumentando, respectivamente, a 250% y 270% después de 72 horas. El incremento en la DO en ambos casos indica un crecimiento bacteriano significativo. La diferencia entre el control y la muestra con PDMS al final del periodo de 72 horas es mínima, sugiriendo que el PDMS no tiene un efecto inhibidor significativo sobre el crecimiento de B. clausii a esta concentración.
En el caso de la concentración de bacterias 1:8 para el PDMS a razón 10:1, el porcentaje de DO inicial del control negativo y positivo fue de aproximadamente 100%, aumentando respectivamente a 450% y 460% después de 72 horas. Nuevamente, el crecimiento bacteriano es evidente en ambas condiciones. La diferencia en DO entre el control y la muestra con PDMS es insignificante, lo que sugiere que, incluso a una menor concentración de B. clausii, el PDMS no afecta significativamente el crecimiento bacteriano. Los comportamientos descritos anteriormente son análogos para las razones de PDMS 10:1.5 y 10:2.
4.2 Viabilidad Celular
En las dos concentraciones de B. clausii evaluadas, los controles y las muestras expuestas al PDMS mantuvieron niveles de UFC comparables entre ellos, cercanos al 100%. Específicamente, para la concentración inicial, el control mostró un 100% de UFC, mientras que la muestra con PDMS se mantuvo en un 103% de UFC con respecto al control. En las diluciones 1:8, se observó un patrón similar, donde tanto los controles como las muestras con PDMS presentaron porcentajes de UFC muy cercanos al 100%, con variaciones mínimas. Este mismo comportamiento se mantuvo para las pruebas realizadas con el PDMS a razón 10:1.5 y 10:2.
Las gráficas presentadas en la Figura 4 muestran el porcentaje de UFC para dos concentraciones de B. clausii: 1 y 1:8. Las barras claras representan los controles negativos (sin exposición a PDMS), mientras que las barras más intensas corresponden a las muestras expuestas al PDMS.
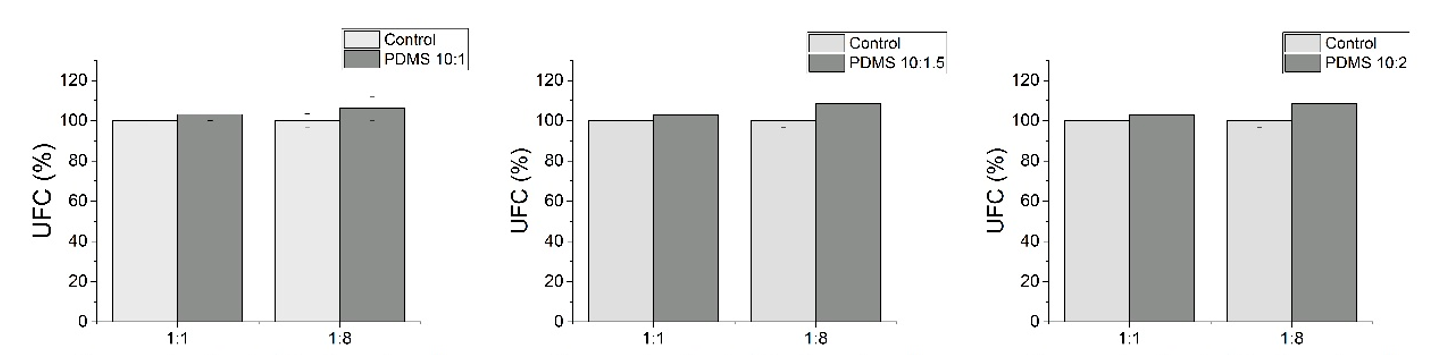
Figura 4. Porcentaje de densidad UFC de B. clausii que estuvieron expuestos a tres diferentes elaboraciones de PDMS
Estos resultados indican que la exposición al PDMS no afectó significativamente la viabilidad de B. clausii en ninguna de las concentraciones evaluadas. La consistencia en el porcentaje de UFC entre las muestras control y las expuestas a PDMS sugiere que el PDMS no ejerce un efecto citotóxico sobre B. clausii, manteniendo la capacidad de las bacterias para formar colonias viables tras la incubación.
Los datos obtenidos de los conteos de UFC refuerzan los hallazgos previos de las mediciones de DO, confirmando que el PDMS no presenta citotoxicidad notable hacia B. clausii en las condiciones experimentales estudiadas. Estos resultados son consistentes a través de diversas concentraciones de base:catalizador, demostrando que el PDMS no afecta la viabilidad bacteriana de manera significativa en ninguna de las presentaciones estudiadas.
Con base en los resultados descritos previamente, se observó que la bacteria Bacillus clausii creció sin experimentar efectos adversos en presencia del polímero estudiado. En comparación con los controles negativos, se concluyó que el PDMS (en proporciones 10:1, 10:1.5 y 10:2, curado durante 28 minutos a 100, 170 y 230 °C, respectivamente) no presenta toxicidad para B. clausii. Esta conclusión se sustentó mediante la evaluación de la cinética de crecimiento y la viabilidad de B. clausii frente al PDMS, considerando tres parámetros distintos de curado.
Este hallazgo es significativo, ya que amplía el rango de parámetros de curado del PDMS para los cuales el proveedor15 reporta que no existe toxicidad.
Es importante señalar que este estudio representa solo una parte de la investigación sobre materiales adecuados para la elaboración de queratoprótesis (córneas artificiales). Si bien B. clausii no es una bacteria común en el entorno ocular, ofrece un buen indicativo preliminar en cuanto a la toxicidad del material. Se tiene previsto realizar pruebas adicionales de viabilidad celular utilizando células oculares específicas, con el fin de emular la respuesta del entorno ocular ante la presencia del elastómero.
Los resultados expuestos en este trabajo indican un patrón de crecimiento similar para B. clausii en presencia y ausencia de PDMS, independientemente de la concentración de la bacteria. Esto sugiere que el PDMS no presenta citotoxicidad notable hacia B. clausii. Esto es consistente para las tres proporciones de base:catalizador con las cuales fue elaborado el elastómero, lo cual indica que la proporción del catalizador en la mezcla, no representa un agente tóxico para la bacteria empleada.
Los resultados obtenidos muestran que la viabilidad celular de B. clausii no es afectada significativamente por la exposición al PDMS independientemente de la cantidad de agente de curado que éste presente.
Lo anterior sugiere una baja o nula citotoxicidad del material en las condiciones experimentales evaluadas, lo que abre una brecha para futuros estudios acerca de la posibilidad de implementar este material en la elaboración de prótesis corneales.