
Actas del Congreso Nacional de
Tecnología Aplicada a Ciencias
de la Salud



Actas del Congreso Nacional de Tecnología Aplicada a Ciencias de la Salud Vol. 6, 2024
En este trabajo se presenta un montaje experimental para la estimulación del sistema de visión periférica humana; consta de 3 monitores que cubren 180° de visión horizontal y 109° de visión vertical, así como de un sistema de electroencefalografía (EEG) de 32 electrodos para el registro de la actividad eléctrica durante el estímulo visual. La estimulación del sistema de visión se realizó mediante un software desarrollado en Python, el cual se divide en cinco etapas para capturar la actividad cerebral. En cada etapa se realizó un video con los tiempos de inicio y fin de las diferentes etapas identificadas para la selección del análisis y procesamiento de las señales de EEG.
Palabras claves: Python, Prediagnóstico de neuropatías ópticas, Campimetría.
This work presents an experimental setup for stimulating the human peripheral vision system. It consists of 3 monitors that cover 180° of horizontal vision and 109° of vertical vision. An Electroencephalographic (EEG) system comprising 32 electrodes to record the electrical activity during the visual stimulus. The stimulation of the vision system is performed using software developed in Python, which is divided into five stages to record brain activity. In each stage, a video is made with the start and end times of the different stages identified for the selection of analysis and processing of the EEG signals.
Keywords: Python, Pre-diagnosis of optic neuropathies, Campimetry.
El glaucoma es una enfermedad ocular progresiva que afecta el nervio óptico y puede resultar en pérdida irreversible de la visión. Actualmente, representa uno de los principales desafíos de la salud visual a nivel mundial [1]. Se estima que más de 76 millones de personas padecen glaucoma a nivel mundial, y se proyecta que esta cifra aumentará a más de 111 millones para el año 2040 [1]. Aunque las estadísticas exactas pueden variar según las fuentes y criterios utilizados, se estima que alrededor de un millón de mexicanos sufre de glaucoma [3]. Un indicador del inicio del glaucoma es la disminución del campo visual. Para la mayoría de la población, el acceso a pruebas de diagnóstico es muy complicado, considerando múltiples factores como el costo, tiempo, especialización de los operarios, entre muchas otras, hasta el momento no existe una prueba de identificación del glaucoma con la anticipación, eficacia, accesibilidad, fácil de aplicar y cómoda de interpretar; esto dadas las características de la población con mayor afectación; es decir, enfermos no diagnosticados principalmente de países en vías de desarrollo, sin un sistema de salud ocular adecuado, sin el poder adquisitivo suficiente para realizarse las pruebas oculares o la visita al oftalmólogo.
Por lo tanto, el objetivo de este trabajo es presentar las etapas preliminares del desarrollo de un prototipo de bajo costo para el prediagnóstico de glaucoma, mediante la estimulación periférica de la visión. Para lograrlo, fue necesario el desarrollo de un software capaz de realizar barridos de estímulos visuales azules dentro de un fondo amarillo en las tres diferentes pantallas del sistema, además del desarrollo de la prueba. Esto implicó la toma de datos en algunos voluntarios. Cabe mencionar que en este trabajo se está siguiendo la declaración de Helsinki.
La campimetría computarizada es un método de diagnóstico que permite caracterizar el campo visual de un paciente mediante un estímulo visual, estos estímulos varían dependiendo del método utilizado, pueden ser objetos físicos como lapiceros, punteros laser sobre una pantalla u objetos y/o formas de alto contraste proyectadas en un monitor. El software especializado controla la aparición de estímulos luminosos de distintas intensidades y tamaños en varias posiciones del campo visual [4]. En la figura 1 mostramos un ejemplo de estos equipos comerciales [5]. El paciente presiona un botón cuando percibe uno de los estímulos visuales, lo que permite mapear las áreas donde la percepción es normal y aquellas donde no lo es.
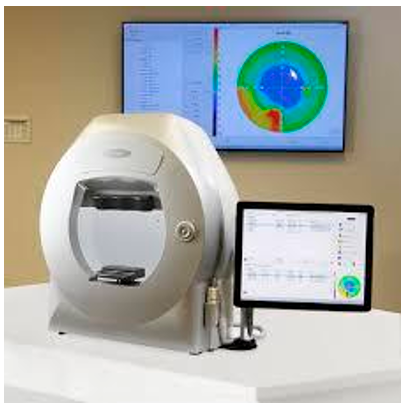
Figura 1. Campímetro computarizado comercial, AP-300 GX2, Bienes de equipos, Montequinto Sevilla, España
2.1 Selección de colores de contraste
En la campimetría computarizada, los colores más utilizados son el blanco y el amarillo; estos son seleccionados por su capacidad de resaltar diferencias en la sensibilidad del campo visual [6]. El blanco es un color estándar debido al contraste que tiene con un fondo obscuro, mientras que el amarillo puede ser útil para evaluar el campo visual en presencia de cataratas, ya que su longitud de onda atraviesa mejor las opacidades del cristalino. Adicionalmente, el uso de estímulos azules sobre un fondo amarillo (campimetría azul-amarillo) han demostrado ser efectivos en la detección temprana de defectos en el campo visual causados por el glaucoma. Esta combinación de colores es más efectiva por la sensibilidad que presentan las células ganglionares pequeñas, debido a que son las primeras en ser afectadas por la enfermedad [7, 8].
2.2 Ventajas y desventajas de la campimetría computarizada
Si bien es cierto que la campimetría computarizada es una técnica con la que se obtienen muy buenos resultados, tiene el gran inconveniente de no poder ser usada en pacientes con discapacidad visual severa. En la tabla 1 se muestran más desventajas y ventajas de la campimetría computarizada comparada con otras técnicas [9-12].
Tabla 1. Comparación entre técnicas de detección de glaucoma
| Técnica | Ventajas | Desventajas |
|---|---|---|
| Campimetría Computarizada | Alta precisión y sensibilidad, rápida, no invasiva, fácil de administrar. | Requiere equipos muy costosos y personal entrenado para la toma de datos. |
| Tonometría | Evaluación rápida y sencilla de la presión intraocular. | No detecta directamente daños en el nervio óptico ni en el campo visual. |
| Tomografía de Coherencia Óptica (OCT) | Proporciona imágenes detalladas del nervio óptico y la capa de fibras nerviosas. | Costosa, requiere equipo muy especializado y no puede detectar cambios funcionales tempranos. |
| Perimetría Manual | Puede ser utilizada en casos donde la tecnología no está disponible. | Menor precisión, mayor tiempo de administración y susceptible a errores del operador y del paciente. |
| Electrorretinografía Multifocal (mfERG) | Detecta disfunción retiniana antes de que aparezcan cambios en el campo visual. | Técnica compleja, requiere equipo especializado y experiencia del operador. |
Como ya se comentó, las tres etapas de este trabajo, mismas que se representan esquemáticamente en la figura 2, serán descritas a detalle en esta sección

Figura 2. Proceso de desarrollo del sistema
3.1 Selección y calibración del hardware
Como primera etapa se realizó el armado del sistema, el cual consta de 3 monitores con una resolución de hasta 1920 x 1080 pixeles [13]. Se seleccionó un dispositivo externo que permite controlar 3 monitores de forma extendida como se observa en la figura 3.

Figura 3. Fotografía del arreglo de 3 monitores
Después se realizaron pruebas para determinar la distancia focal y la apertura de los monitores, con el fin de garantizar una apertura lateral de 180° y una apertura superior de 54.46°, tal como se esquematiza en la figura 4.
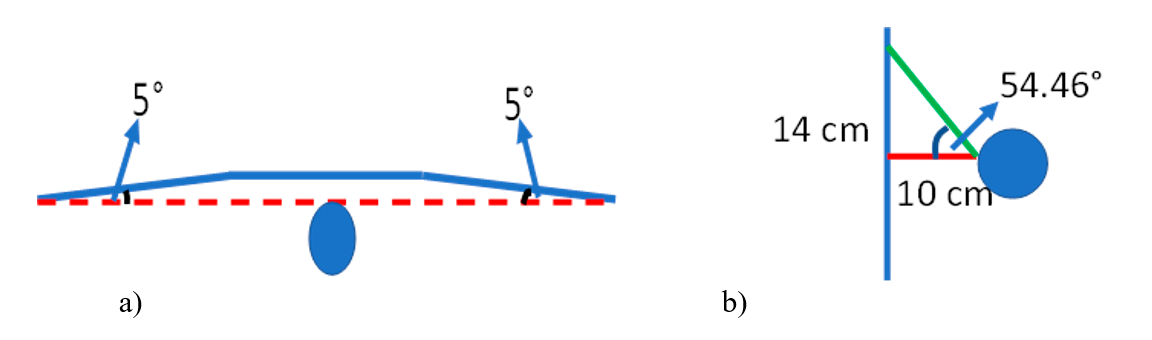
Figura 4. Esquema del arreglo de monitores. a) vista área y b) vista lateral
En la figura 5 se muestra el procedimiento para la calibración del campo visual. Para ello, se seleccionaron los colores verde y azul para no fatigar la vista. Primero, se realizó un barrido horizontal del cuadro azul y se solicitó a los voluntarios presionar un botón del mouse cuando observaran el estímulo azul. Esto detiene el programa y permite medir la distancia a la cual se observó el estímulo, y comprobar si se cubre el rango esperado. Posteriormente se realizó un barrido vertical, solicitando nuevamente que oprimieran el botón del ratón y comprobar con ello la apertura esperada.

Figura 5. Calibración del sistema físico
Para el registro electroencefalográfico, se empleó la gorra de 32 electrodos del sistema EMOTIV EPOC Flex Wireless saline model (Figura6). Las señales electroencefalográficas se obtuvieron con un muestreo secuencial simple de 128 sps, 14 bits de resolución y un ancho de banda de 0.2- 45 Hz [14]. Se realizaron pruebas con sujetos voluntarios para identificar los electrodos activos durante la presentación de los estímulos visuales.

Figura 6. Gorra para electroencefalografía EMOTIV EPOC Flex Wireless saline model
3.2 Desarrollo del software
El software utilizado se desarrolló en Python. Este cuenta con diferentes etapas, en cada una de ellas se realiza un proceso para la visión y toma de información. El software muestra las instrucciones para cada etapa, lo que permite disminuir la interacción del operador con el paciente. Lo anterior evita cualquier perturbación que pueda alterar el registro electroencefalográfico. Dentro de las primeras dos etapas (Figura7), se realizó la calibración de la gorra para electroencefalografía. Se solicitó a los voluntarios mantener los ojos abiertos durante un lapso de tiempo (especificar cuánto tiempo) y después cerrados durante el mismo lapso de tiempo. Lo anterior permite que los electrodos registren movimientos oculares o parpadeos. Esto permite eliminar artefactos de movimiento en el análisis y procesamiento de datos.

Figura 7. Etapas de calibración del software
En la tercera etapa, colocamos una pantalla amarilla con un punto negro en el centro como punto de referencia (Figura 8), para producir una mejor respuesta al estímulo azul (ver apartado 2,2) al generar la saturación de los cono-receptores para los colores rojo y verde.
Para la cuarta etapa se mostró la misma pantalla amarilla con la presentación del estímulo azul de manera aleatoria con distribución de probabilidad uniforme, tanto en espacio como en tiempo. Un vector con dimensiones del número de estímulos que pueden aparecer sobre las dimensiones de todo el arreglo de monitores es creado, tanto para el eje x como para el eje y, cuando un elemento del vector en y es utilizado, este elemento es eliminado lo que reduce la dimensión del vector, el barrido no concluirá hasta que este vector se quede sin elementos. Es importante señalar que el tiempo de permanencia del estímulo azul es de 1 segundo. En esta etapa solicitamos al voluntario observar la pantalla solamente, para contar con datos de posición del estímulo. Posteriormente se verificó con las señales EEG, la posibilidad de detectar los estímulos visuales sin necesidad de que el voluntario realice alguna acción mecánica.

Figura 8. Pantalla amarilla con estímulo azul
Por último, en la quinta etapa (Figura 9), se realizó un barrido similar al de la etapa cuatro. Sin embargo, este estímulo se mostró en diferentes coordenadas, para evitar que el sujeto recuerde la prueba y automatice sus respuestas. Además, solicitamos al sujeto que presionara el botón del mouse cada vez que observara el estímulo azul para almacenar los datos de posición y tiempo de reacción. Con esto, detectamos falsos positivos o falsos negativos al realizar la comparación entre los vectores con los que se generan los estímulos y el vector en el que se almacenaron las respuestas del voluntario. Esta información nos ofreció la posibilidad de evaluar la respuesta en las áreas en las que no fueron detectados los estímulos y corroborar si la persona no fue capaz de visualizarlos. Todos estos datos fueron almacenados en una hoja de Excel (Figura 9) para su posterior análisis y procesamiento.

Figura 9. Muestra de resultados de toma de datos: a) hoja de Excel obtenida; b) toma de datos en un paciente
Como parte complementaria, se diseñó un soporte para la barbilla con el objetivo de mantener la misma distancia de los ojos del sujeto a las pantallas. Esto permitió que las personas se encontraran cómodas al momento de la prueba.
3.3 Toma de datos muestra
Por último, se realizó la toma de datos a personas voluntarias en un rango de edad de 20 a 38 años. A continuación, se enlista el procedimiento realizado en la toma de datos:
Se realizaron experimentos en 6 pacientes (2 mujeres y 4 hombres, de un rango de edad de 20-38 años). En la toma de datos se han podido observar diferentes puntos que afectan al sistema y los cuales representan áreas de oportunidad como trabajo futuro.
El proceso de la toma de datos se puede dividir en 3 etapas que se detallan en seguida. En la primera etapa denominada Acondicionamiento, se consideran varios detalles y se sugiere dejar todo el equipo EEG listo un día antes de la toma de datos, esto implica, los electrodos colocados en la gorra, las almohadillas de fieltro fuera de cada electrodo, monitores y soporte de barbilla en posición adecuada, solo para realizar el mínimo de justes.
La Toma de Datos <
La tercera y última etapa del proceso experimental consiste en la detención de la lectura de datos de los electrodos, apagar el software, detener la grabación del video, desconectar el dispositivo Control Box de la gorra, quitar la gorra al sujeto y guardar los tres archivos del experimento (video, archivo de datos del EEG y archivo de respuesta manual a los estímulos).
En la figura 10 se presentan lecturas de cada una de las etapas del experimento grabadas por el software EMOTIVPRO del dispositivo EEG.
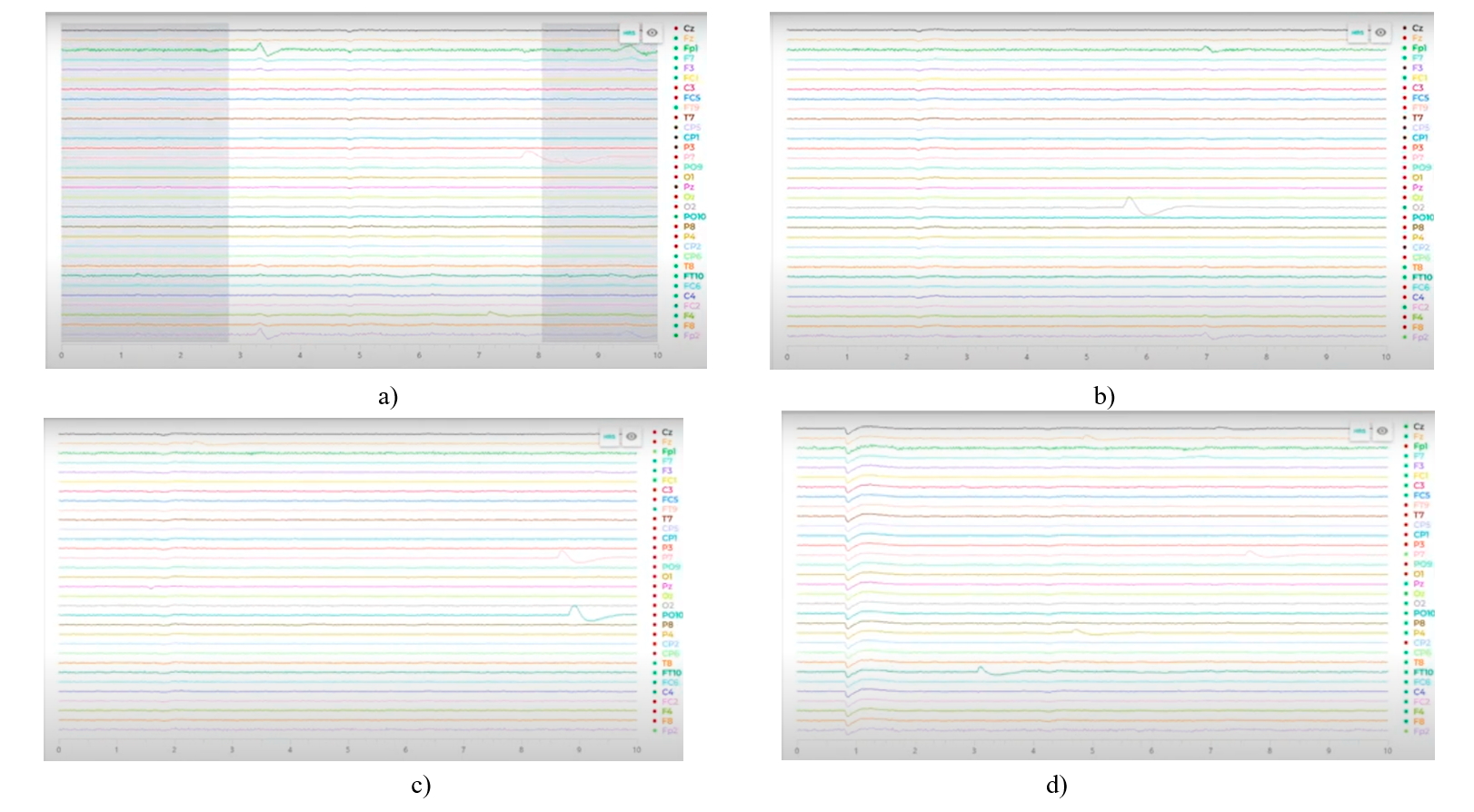
Figura 10. Lectura de los electrodos del EEG durante 10 segundos. a) Transición de “ojos cerrados” a “ojos abiertos”. b) Sin estímulo visual, enfocando la vista en el punto central marcado en la pantalla. c) Estimulo visual periférico. d)Estimulo visual con actividad motora
En la Figura11 se presenta una muestra de la toma del video en uno de los experimentos y gráficas de los datos crudos arrojados por el software. Estos últimos son los que se analizarán con diferentes técnicas de procesamiento de señales para encontrar la correlación de los estímulos en la visión periférica y las señales detectadas por cada uno de los electrodos.
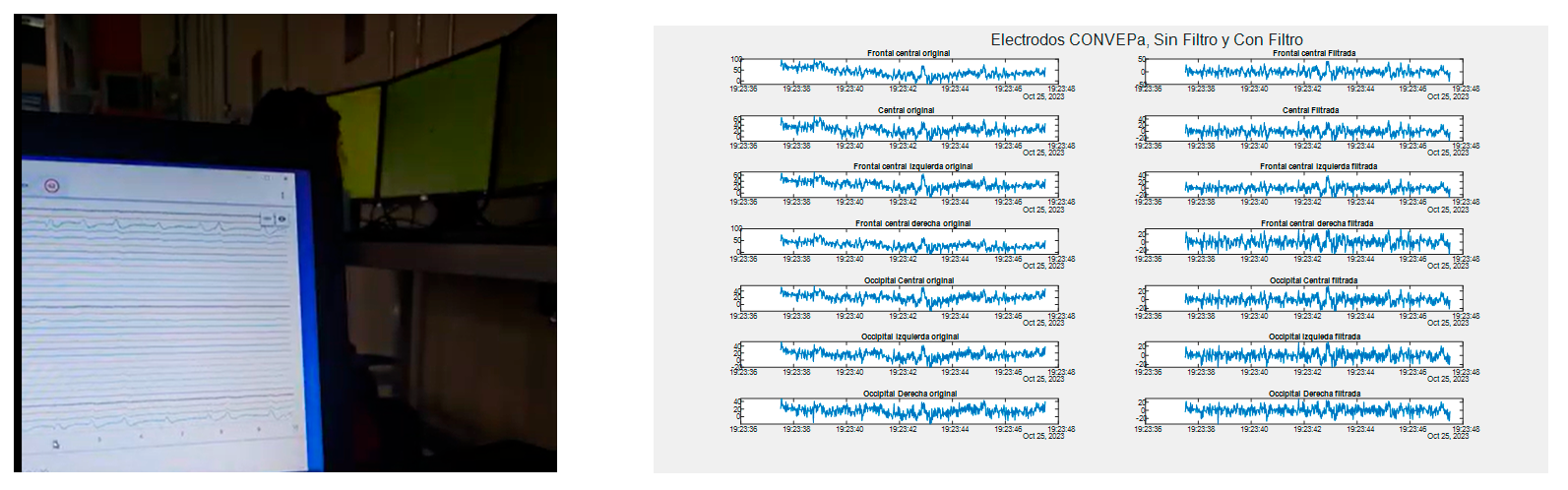
Figura 11. Resultados a) Captura de pantalla de uno de los videos tomados en cada experimento. b) Grafica de los datos duros obtenidos del EEG.
En este estudio, hemos explorado los límites de la visión periférica en voluntarios de diferentes edades. Los resultados indican que el sistema desarrollado es capaz de cubrir sin dificultad los límites laterales e incluso sobrepasarlos en algunos participantes. No obstante, se han encontrado dificultades para cubrir los límites superiores e inferiores. La visión superior puede ser abarcada si se acerca al paciente al dispositivo.
Se detectaron dos problemas si los sujetos se sientan muy cerca de los monitores: en primer lugar, la visión se fatiga rápidamente debido a la intensidad del color; en segundo lugar, se produce un desenfoque durante periodos prolongados, lo cual podría generar resultados erróneos. Para mitigar estos inconvenientes, se propone reducir el brillo y la saturación de los colores en los monitores mediante el software, además de alejar al paciente a una distancia de 20 cm y concentrar el estudio en la visión superior.
Esta decisión se basa en la literatura [17, 18], que indica que el glaucoma en etapas tempranas se manifiesta principalmente en las zonas superiores, tanto a la derecha como a la izquierda. Para llevar a cabo esta adaptación, moveremos el punto de referencia hacia la parte inferior, enfocando la vista en la parte superior. A pesar de estos desafíos, el sistema ha demostrado ser eficaz para detectar la sensibilidad de la visión periférica y determinar los rangos óptimos para nuestros estudios.